Immunologie und Zellbiologie

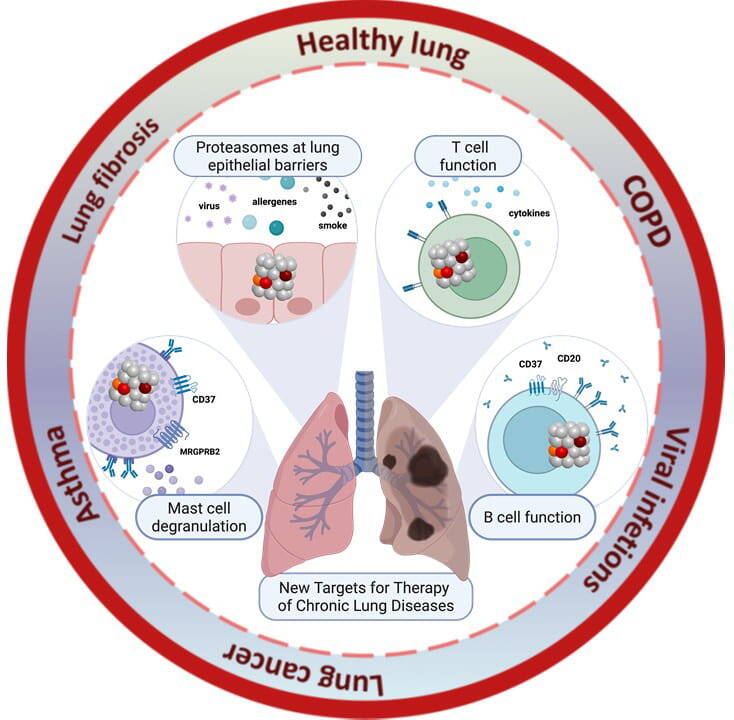
Ein genaues Verständnis der Immunregulation in der gesunden und erkrankten Lunge ist wichtig, um neue Therapieziele für chronische Lungenerkrankungen zu identifizieren. Unsere Arbeitsgruppe erforscht die Regulation des proteasomalen Proteinabbaus und die Signalweiterleitung an Zellmembranen. Dabei untersuchen wir Lungenepithel- und Immunzellen. Ein Schwerpunkt liegt auf der Rolle des Proteasoms in der epithelialen Immunantwort und in Immunzellen. Zudem analysieren wir die Funktion membranassoziierter Tetraspanine in B- und Mastzellen und deren Fehlregulation bei Lungenerkrankungen.
Immunoproteasom-Forschung (Meiners lab)
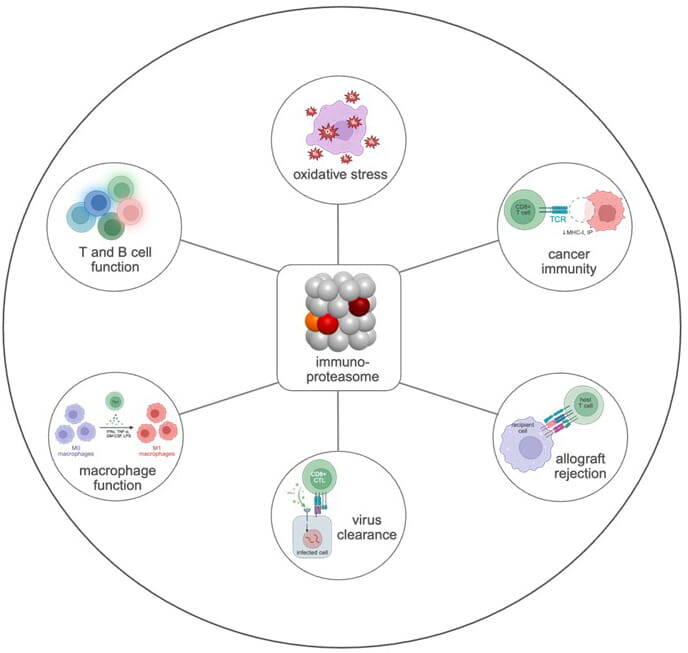
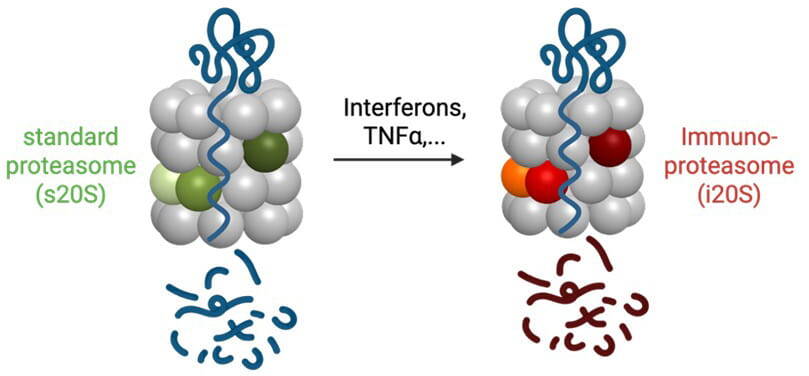
Ein Forschungsschwerpunkt ist das Immunoproteasom, eine spezialisierte Form des Proteasoms, das eine wichtige Rolle bei der Regulation von Immunreaktionen spielt. In Immunzellen wird das Immunoproteasom (i20S) konstitutiv exprimiert, während in Nicht-Immunzellen wie beispielsweise in Epithelzellen, das Standard Proteasom (s20S) vorherrscht, das i20S aber durch inflammatorische Signale und Infektionen induziert werden kann (Abbildung 1). Das Immunoproteasom besitzt eine andere proteolytische Aktivität als das s20S und spielt eine Schlüsselrolle bei der Regulierung von Immun- und Stressreaktionen wie beispielsweise der Aktivierung von CD8 T Zellen durch MHC Klasse I Antigenpräsentation bei Virus- und Tumorerkrankungen (Abbildung 2). Die genaue Funktion des Immunoproteasoms in Immunzellen, bei der Antwort auf Infektionen und in chronischen Lungenerkrankungen wie COPD, pulmonaler Fibrose und Lungentumoren ist jedoch unzureichend verstanden.
Unsere Forschung zielt darauf ab, die Rolle des Immunoproteasoms für die Funktion von Immun- und parenchymalen Zellen und seine Fehlregulierung bei Krankheiten zu erforschen. Derzeit etablieren wir neuartige transgene Tiermodelle für die Immunoproteasom-Forschung, die wir für die Validierung spezifischer Immunoproteasom-Inhibitoren als neuen Behandlungsansatz für entzündliche und chronische Krankheiten nutzen wollen. Für klinische Studien haben wir Methoden zur systematischen Bestimmung der Proteasomen-Aktivität in peripheren Blutzellen etabliert, um damit große Patienten- oder Populationskohorten auf veränderte Proteasomen-Aktivitäten zu untersuchen.
Membranproteine (Orinska Lab)
Unser Schwerpunkt ist die Regulierung der Funktion von B-Zellen und Mastzellen und ihre Rolle bei der Immunantwort in physiologischen Situationen und bei chronischen Lungenerkrankungen. Insbesondere möchten wir verstehen, wie Membranproteine der Tetraspanin-Familie an der Regulierung der Immunzellfunktion beteiligt sind und ob/wie die Modulation der Tetraspaninfunktion für die Behandlung von chronischen Lungenerkrankungen eingesetzt werden kann. Mit Hilfe verschiedener genetischer Mausmodelle und Antikörper-vermitteltem Tetraspanin-Targeting charakterisieren wir zelltypspezifische Interaktionspartner und Funktionen dieser Membranproteine.
Leibniz-Gemeinschaft „ImmunoPROteasomen in LUNGen Gesundheit und Krankheit“ - PRO-LUNG
Wir untersuchen hier die Hypothese, dass die induzierbare Natur des Immunoproteasoms eine dynamische Anpassung der Proteasomfunktion bei Immun- und Stressreaktionen ermöglicht. Insbesondere wollen wir verstehen, ob Standard-, Immuno- und die verschiedenen Arten von gemischten Proteasomen unterschiedliche Funktionen haben. Dazu wollen wir die Expression in verschiedenen Zelltypen und wie der Abbau unterschiedlicher Substrate oder die Interaktion mit bestimmten Proteasom-Regulatoren in subzellulären Kompartimenten funktioniert untersuchen. Die Klärung dieser Fragen ist der Schlüssel zu einem detaillierten Verständnis der Funktion des Immunproteasoms unter physiologischen und pathophysiologischen Bedingungen. Wir wollen damit das Immunoproteasom als therapeutisches Ziel für die Behandlung chronischer Lungenerkrankungen validieren.
Leibniz-Zentrum für Infektionsforschung: „Geschlechtsspezifische Regulation der Immunoproteasom-Funktion bei Infektionen“
(zusammen mit Bianca Schneider, FZB)
In diesem Projekt analysieren wir die (biologische) geschlechtsspezifische Regulierung des Immunoproteasoms und ob dies zu veränderten Immunantworten gegen Infektionen bei Frauen beitragen könnte. Wir verwenden Influenza- und Tuberkulose-Infektionsmodelle in weiblichen und männlichen Mäusen sowie zelluläre Modelle für die Behandlung mit Sexualhormonen, um so die Immunoproteasom-bezogene Immunantwort zu untersuchen. Ziel ist es, die molekularen Grundlagen der geschlechtsspezifischen Regulierung des Immunoproteasoms zu entschlüsseln und somit das Immunoproteasom therapeutisch auf geschlechtsspezifische Weise zu beeinflussen.

SFB 1713 Mütterliche Immunaktivierung: „Rolle des Immunoproteasoms bei der foeto-maternalen Immunaktivierung und dem foetalen Immunpriming“
Das Immunoproteasom ist wesentlich an der Selektion und dem Priming von CD8 T-Zellen beiteiligt. Es ist somit zentral für die Etablierung von Selbsttoleranz sowie anti-viraler und Auto-Immunität. In diesem Projekt untersuchen wir die Regulierung des Immunoproteasoms durch Stress- und Infektions-bedingte mütterliche Immunaktivierung (MIA) und wie sich dies auf die anti-viralen Immunantworten im schwangeren Wirt, das Immunpriming im fötalen Thymus und die Entwicklung der Toleranz bei den Nachkommen auswirkt.

Schwerpunktprogramm SPP2453 Mitostress: „Regulation des menschlichen Proteostasennetzwerks unter mitochondrialem Proteinimportstress“
Mitochondrien sind zentral für den zellulären Metabolismus und die Aufrechterhaltung der Proteostase. Da der Großteil mitochondrialer Proteine im Zytosol synthetisiert und anschließend importiert wird, ist eine präzise Regulation des mitochondrialen Proteinimports essenziell für die Aufrechterhaltung der zellulären Funktion. Ziel dieses Projekts ist es, die Regulierung des Proteasomsystems unter mitochondrialen Stressbedingungen im Detail zu charakterisieren. Ein besonderer Fokus liegt auf den Mechanismen zur schnellen Anpassung der proteasomalen Regulation bei mitochondrialem Importstress.

Regulierung der MrgprB2-vermittelten Mastzellenaktivierung durch Tetraspanin CD37
Mastzellen (MZs) sind langlebige Sentinelzellen des Immunsystems, die allergische und entzündliche Reaktionen steuern. Während das Tetraspanin CD37 als wichtiger Regulator der Signalübertragung in B-Zellen bekannt ist, ist seine Funktion in der Mastzellaktivierung bislang unzureichend verstanden. Hier untersuchen wir, wie CD37 die Aktivierung von Mastzellen reguliert, indem wir zwei genetische Modelle der CD37-Defizienz vergleichen. Mastzellen aus konventionell CD37-defizienten Mäusen reagierten überempfindlich auf IgE-unabhängige, MrgprB2-vermittelte Stimulation. Im Gegensatz dazu zeigten Mastzellen aus mastzellspezifischen CD37-Knockout-Mäusen keine veränderte Aktivierbarkeit und reagierten auf IgE-abhängige und IgE-unabhängige Stimuli unauffällig. Die beobachtete IgE-unabhängige Überempfindlichkeit in konventionell CD37-defizienten Mäusen könnte auf einen Off-Target-Effekt zurückzuführen sein. Um diese Hypothese zu überprüfen, rekonstituieren wir die CD37-Expression in CD37-defizienten Mastzellen mittels lentiviraler Transduktion. Darüber hinaus haben wir ein benachbartes Gen identifiziert, das als potenzieller neuer Regulator der Mastzellaktivierung in Frage kommt.
Modulation der B-Zell-Funktion durch Epitop-spezifisches CD37-Targeting in der Maus
CD37 ist ein glykosyliertes Membranprotein, das in B-Zellen stark exprimiert wird. Wie andere Tetraspanine ist auch CD37 an der Regulierung eingehender Signale, lateralen Membranprotein-Interaktionen und der intrazellulären Signalverarbeitung beteiligt. In diesem Projekt charakterisieren wir CD37-spezifische monoklonale Antikörper und untersuchen die Auswirkungen des epitopspezifischen CD37-Targetings in vitro und in vivo. Die CD37-spezifischen monoklonalen Antikörper erkennen zwei verschiedene CD37 Epitope. Die Bindung der Antikörper an CD37 führt zur Induktion des Zelltods der B-Zellen in vitro. Auch in der Maus führt die Applikation von CD37 AK zu einer Reduktion verschiedener B-Zellpopulationen. Trotzdem konnten wir auch eine spezifische Immunantwort auf injizierte Antikörper beobachten, was auf die Aktivierung bestimmter B-Zell-Populationen hindeutet. In weiteren Experimenten werden wir die Mechanismen untersuchen, die für die Depletion der B-Zellen verantwortlich sind und die für die Behandlung von chronischen Lungenerkrankungen eingesetzt werden könnten. Die verstärkte Induktion einer Immunantwort dagegen ist für die Entwicklung neuer Impfstofftechnologien von Bedeutung.
- „Leibniz Best Minds“ Professorinnen-Programm: „ImmunoPROteasome in LUNG health and disease“ (2021-2026)
- Leibniz-Zentrum für Infektionsforschung (LCI): „Geschlechtsspezifische Regulation der Immunoproteasom-Funktion bei Infektionen“ (gemeinsam mit Bianca Schneider, FZB, 2023-2026)
- Deutsches Zentrum für Lungenforschung (DZL) (2023-2027)
- DFG: „Regulation des menschlichen Proteostasennetzwerks unter mitochondrialem Proteinimportstress“ im Rahmen des SPP 2453 (2024 - 2027)
- Precision medicine in inflammation (PMI) excellence cluster (2025-2030)
- Dorothea-Erxleben-Preis des Exzellenzclusters „Präzisionsmedizin bei Entzündungen“ (2024)
- DFG: „Rolle des Immunoproteasoms bei der foeto-maternalen Immunaktivierung und dem foetalen Immunpriming“ im Rahmendes SFB 1713 (2025-2028)
- Primärkultur von Lungen- und Immunzellen von Mensch und Maus
- Biochemische Analysen der Proteasom-Aktivität (Nativgel, Aktivitätstests)
- Virusinfektionen, lentivirale Gentransduktion und CrispRCas9-basiertes Genediting
- transgene Mausmodelle
- Molekularbiologisch basierte Methoden
- Zellbiologische Assays für Wachstum, Überleben, Migration und Differenzierung
- CD8+ T-Zell-Reporter-Assays
- Analyse der MC-Degranulation
- Analyse der Differenzierung und Reifung von B-Zellen
- Induktion und Messung der spezifischen Immunantwort in der Maus
- Multiparametrische Durchflusszytometrie
- Messung der IgA vermittelten Immunantwort an Schleimhautoberflächen
- Synthese von Peptidbibliotheken für das Epitopmapping von Antikörpern
- Festphasensynthese von Peptiden und Peptidderivaten
- in silico/in vitro Peptidsequenzoptimierung
- Peptid basierte Arraysysteme
- Peptidprobes für das Life cell Imaging
2026
Baker, J, Beaulieu, D, Huang, E, Avci, E, Savai, R, Meiners, S, Eickelberg, O, Lehmann, M & Königshoff, M 2026 ‘Hallmarks of the ageing lung – 10 years later’ European Respiratory Journal (accepted ahead of print)
Meiners, S & Cataldo, D 2026, 'Repairing the lung: from single cells and tissue organisation to regenerative therapy - highlights of the Lung Science Conference 2025', European Respiratory Review, Jg. 35, Nr. 179. https://doi.org/10.1183/16000617.0191-2025
Yazgili, AS, Giotopoulou, GA, Behrend, SJ, Koops, F, Welk, V, Meul, T, Zemke, L, Reiling, N, Goldmann, T, Stathopoulos, GT & Meiners, S 2026 ‘PA200 differentially regulates the proteasome and inhibits migration of NSCLC cells’ Journal of Cell Science (accepted ahead of print)
2025
Eibach, Y, Kreher, S, Poetsch, MS, Kho, AL, Gaertner, U, Clemen, CS, Schröder, R, Guo, K, Milting, H, Meder, B, Potente, M, Richter, M, Schneider, A, Meiners, S, Gaute, M & Braun, T 2025, 'The deubiquitinase USP5 prevents accumulation of protein aggregates in cardiomyocytes', Science advances, Jg. 11, Nr. 4, S. eado3852. https://doi.org/10.1126/sciadv.ado3852
Faner, R, Cho, MH, Koppelman, GH, Melén, E, Verleden, SE, Dharmage, SC, Meiners, S & Agusti, A 2025, 'Towards early detection and disease interception of COPD across the lifespan', European Respiratory Review, Jg. 34, Nr. 177. https://doi.org/10.1183/16000617.0243-2024
Harikumar Parvathy, G*, Hertz, D*, Bhandiwad, D, Eggers, L, von Borstel, L, Behrends, J, Hein, M, Dreyer, V, Marschner, J, Orinska, Z, Niemann, S, Kaufmann, SHE, Goldmann, T, Lotter, H, Flores-Valdez, MA & Schneider, BE 2025, 'Sex Differences in Vaccine-Induced Immunity and Protection Against Mycobacterium tuberculosis', THE JOURNAL OF INFECTIOUS DISEASES, S. jiaf277. https://doi.org/10.1093/infdis/jiaf277 *authors contributed equally
Lunding, LP, Weckmann, M, Zissler, UM, Jakwerth, C, Bodenstein-Sgró, R, Webering, S, Vock, C, Ehlers, JC, Fernandez Ceballos, RAM, Nemani, SSP, Reddy, KD, Oliver, BGG, Vermeulen, CJ, van de Berge, M, Ober, C, Künstner, A, Busch, H, König, I, Garbers, C, Schmidt-Weber, CB, Nold, MF, Yildirim, AÖ, Nold-Petry, CA, Orinska, Z, Bahmer, T, Heyckendorf, J, Hansen, G, von Mutius, E, Rabe, KF, Dittrich, A-M, Schaub, B, Brinkmann, F, Kopp, MV, Wegmann, M & ALLIANCE Study Group 2025, 'Immune Training of the Interleukin 6 Gene in Airway Epithelial Cells is Central to Asthma Exacerbations', ALLERGY. https://doi.org/10.1111/all.70070
Mendoza, N & Meiners, S 2025, 'COPD, IPF and Tobacco: What are the Common (Immune) Denominators?', Archivos de bronconeumologia. https://doi.org/10.1016/j.arbres.2025.01.006
Pepke-Żaba, J, Chorostowska-Wynimko, J, Ryan, S, Randerath, W, Meiners, S, Saglani, S, Heuvelin, E, Genton, C, Gappa, M, Powell, P, Polverino, E, Roche, N & Siddiqui, S 2025, 'ERS Clinical Research Collaboration programme: more than research networking - enriching respiratory science and impacting clinical practice in Europe and beyond', The European respiratory journal, Jg. 65, Nr. 3. https://doi.org/10.1183/13993003.02520-2024
2024
Abu Risha, M, Reddy, KD, Nemani, SSP, Jakwerth, C, Schmidt-Weber, C, Bahmer, T, Hansen, G, von Mutius, E, Rabe, KF, Dittrich, A-M, Grychtol, R, Maison, N, Schaub, B, Kopp, MV, Brinkmann, F, Meiners, S, Jappe, U, Weckmann, M & ALLIANCE Study Group 2024, 'Epigenetic training of human bronchial epithelium cells by repeated rhinovirus infections', ALLERGY, Jg. 79, Nr. 12, S. 3385-3400. https://doi.org/10.1111/all.16388
Meiners, S, Reynaert, NL, Matthaiou, AM, Rajesh, R, Ahmed, E, Guillamat-Prats, R, Heijink, IH & Cuevas-Ocaña, S 2024, 'The importance of translational science within the respiratory field', Breathe, Jg. 20, Nr. 1, S. 230183. https://doi.org/10.1183/20734735.0183-2023
2023
Chen, J, Wang, X, Schmalen, A, Haines, S, Wolff, M, Ma, H, Zhang, H, Stoleriu, MG, Nowak, J, Nakayama, M, Bueno, M, Brands, J, Mora, AL, Lee, JS, Krauss-Etschmann, S, Dmitrieva, A, Frankenberger, M, Hofer, TP, Noessner, E, Moosmann, A, Behr, J, Milger, K, Deeg, CA, Staab-Weijnitz, CA, Hauck, SM, Adler, H, Goldmann, T, Gaede, KI, Behrends, J, Kammerl, IE & Meiners, S 2023, 'Antiviral CD8+ T cell immune responses are impaired by cigarette smoke and in COPD', The European respiratory journal, Jg. 62, Nr. 2, 2201374. https://doi.org/10.1183/13993003.01374-2022
Farr, A, Cuevas Ocaña, S, Gille, T, Pinnock, H, Bonsignore, MR, Roche, N, Laveneziana, P, Costello, RW, Harari, S, Meiners, S, Loukides, S & Cruz, J 2023, 'What to expect from the ERS International Congress 2023', Breathe, Jg. 19, Nr. 2, S. 230107. https://doi.org/10.1183/20734735.0107-2023
Javitt, A, Shmueli, MD, Kramer, MP, Kolodziejczyk, AA, Cohen, IJ, Radomir, L, Sheban, D, Kamer, I, Litchfield, K, Bab-Dinitz, E, Zadok, O, Neiens, V, Ulman, A, Wolf-Levy, H, Eisenberg-Lerner, A, Kacen, A, Alon, M, Rêgo, AT, Stacher-Priehse, E, Lindner, M, Koch, I, Bar, J, Swanton, C, Samuels, Y, Levin, Y, da Fonseca, PCA, Elinav, E, Friedman, N, Meiners, S & Merbl, Y 2023, 'The proteasome regulator PSME4 modulates proteasome activity and antigen diversity to abrogate antitumor immunity in NSCLC', Nature cancer, Jg. 4, Nr. 5, S. 629-647. https://doi.org/10.1038/s43018-023-00557-4
Schmalen, A, Kammerl, IE, Meiners, S, Noessner, E, Deeg, CA & Hauck, SM 2023, 'A Lysine Residue at the C-Terminus of MHC Class I Ligands Correlates with Low C-Terminal Proteasomal Cleavage Probability', Biomolecules, Jg. 13, Nr. 9, S. 1300. https://doi.org/10.3390/biom13091300
Wang, X, Zhang, H, Wang, Y, Bramasole, L, Guo, K, Mourtada, F, Meul, T, Hu, Q, Viteri, V, Kammerl, I, Konigshoff, M, Lehmann, M, Magg, T, Hauck, F, Fernandez, IE & Meiners, S 2023, 'DNA sensing via the cGAS/STING pathway activates the immunoproteasome and adaptive T-cell immunity', EMBO JOURNAL , Jg. 42, Nr. 8, S. e110597. https://doi.org/10.15252/embj.2022110597
2022
Bramasole, L & Meiners, S 2022, 'Profiling Proteasome Activities in Peripheral Blood – A Novel Biomarker Approach', Journal of cellular Immunology, Jg. 4, Nr. 5, S. 171-179. https://www.scientificarchives.com/public/assets/articles/article-pdf-1668627159-888.pdf
Kammerl, IE, Hardy, S, Flexeder, C, Urmann, A, Peierl, J, Wang, Y, Vosyka, O, Frankenberger, M, Milger, K, Behr, J, Koch, A, Merl-Pham, J, Hauck, SM, Pilette, C, Schulz, H & Meiners, S 2022, 'Activation of immune cell proteasomes in peripheral blood of smokers and COPD patients - implications for therapy', The European respiratory journal, Jg. 59, Nr. 3, 2101798. https://doi.org/10.1183/13993003.01798-2021
Meiners, S, Yazgili, A & Ebstein, F 2022, 'The proteasome activator PA200/PSME4: an emerging new player in health and disease', Biomolecules, Jg. 12, Nr. 8, S. 1150. https://doi.org/10.3390/biom12081150
Nsiah-Dosu, S, Scholz, C, Orinska, Z, Sadik, CD, Ludwig, RJ, Schmidt, E, Zillikens, D & Hartmann, K 2022, 'Mast cell-deficient mice Mcpt5Cre/Dicerfl/fl redefine the role of mast cells in experimental bullous pemphigoid', Skin Health and Disease, Jg. 2, Nr. 1, e70, S. e70. https://doi.org/10.1002/ski2.70
Schlesser, C, Meul, T, Stathopoulos, G & Meiners, S 2022, 'Metformin Induces Resistance of Cancer Cells to the Proteasome Inhibitor Bortezomib', Biomolecules, Jg. 12, Nr. 6, 756. https://doi.org/10.3390/biom12060756
Zambusi, A, Novoselc, KT, Hutten, S, Kalpazidou, S, Koupourtidou, C, Schieweck, R, Aschenbroich, S, Silva, L, Yazgili, AS, van Bebber, F, Schmid, B, Möller, G, Tritscher, C, Stigloher, C, Delbridge, C, Sirko, S, Günes, ZI, Liebscher, S, Schlegel, J, Aliee, H, Theis, F, Meiners, S, Kiebler, M, Dormann, D & Ninkovic, J 2022, 'TDP-43 condensates and lipid droplets regulate the reactivity of microglia and regeneration after traumatic brain injury', Nature neuroscience, Jg. 25, Nr. 12, S. 1608-1625. https://doi.org/10.1038/s41593-022-01199-y
2021
Kammerl IE, Flexeder C, Karrasch S, Thorand B, Heier M, Peters A, Schulz H, Meiners S. Blood Immunoproteasome Activity Is Regulated by Sex, Age and in Chronic Inflammatory Diseases: A First Population-Based Study. Cells. 2021 Nov 28;10(12):3336.
Additional publications of Silke Meiners not affiliated with the Research Center Borstel
2024
Parvathy, GH, Bhandiwad, D, Eggers, L, Borstel, LV, Behrends, J, Hein, M, Hertz, D, Marschner, J, Orinska, Z & Kaufmann, SHE et al. 2024, 'Sex differences in vaccine induced immunity and protection against Mycobacterium tuberculosis', Biorxiv, S. 2024.04.20.590403. https://doi.org/10.1101/2024.04.20.590403
Leitung der Forschungsgruppe

Wissenschaftliche Mitarbeiter:innen







Technische Mitarbeiter:innen



Alumni
- Laylan Bramasole
- Fatima Mourtada
- Yuqin Wang