Klinische Infektiologie

Aktuelles
04.02.2026: Prof. Christoph Lange mit dem Oskar-Medizinpreis 2025 ausgezeichnet
26.01.2026: DanGerouS Mycobacteria Club traf sich 2026 in Malmö
15.01.2026: Herzliche Glückwünsche zur Habilitation, Priv. Doz. Dr. Thomas Theo Brehm!
12.01.2026: Nicht-invasive Diagnostik der Tuberkulose aus Atemschutzmasken
22.12.2025: Ein Schuhkarton für Kharkiv: Ein wichtiges Zeichen der Solidarität!
22.12.2025: Erhöhtes Tuberkuloserisiko nach Organtransplantationen in Europa
19.12.2025: Neue klinische Standards stärken Antimicrobial Stewardship in der Tuberkuloseversorgung
Wir möchten die Prävention, Diagnostik und Therapie der Tuberkulose und anderer pulmonaler Infektionskrankheiten substantiell verbessern und wissenschaftliche Fortschritte in die klinische Praxis übertragen.
Schwerpunkte
UNITE4-TB: Klinische Leitung UNITE4-TB, Koordination der Europäischen Studienzentren und führende Rolle in der Biomarkerentwicklung im Rahmen einer von der EU-Industrie finanzierten internationalen Plattform von Phase-II-Studien zur Entwicklung neuer TB-Therapieschemata.
TB-X: Identifizierung und Validierung von Biomarkern zur Vorhersage des Therapie-Ansprechens, des Auftretens unerwünschter Nebenwirkungen und der individuellen Dauer der TB-Behandlung.
Arzneimittelresistente TB: Epidemiologische Untersuchungen und Evaluierung molekularer Instrumente zur Identifizierung von Mycobacterium tuberculosis Arzneimittelresistenzen bei Erwachsenen und Kindern, Entwicklung neuartiger Antibiotika und internationaler Leitlinien zur Behandlung medikamentenresistenter Tuberkulose.
DZIF (Deutsches Zentrum für Infektionsforschung)
- DZIF Klinisches Tuberkulose-Zentrum (Clin TB)
- Deutsche TB-Kohorte / TB-Proben Bio-Repository
- Eastern European Study Site (EESS)
- Pädiatrische Diagnosekohorte
- Therapeutic Drug Monitoring (TDM)
- Risc Score
- DZIF MD Projekte
- Implementierung und Evaluierung des Targeted Next-Generation Sequencing (tNGS) Assay ‘FreezeTB’ für medikamentenresistente Tuberkulose in der Republik Moldau
BMG (Bundesministerium für Gesundheit) - GHPP (Global Health Protection Programme)
- Targeted Next-Generation Sequencing (tNGS) bei medikamentenresistenter Tuberkulose (TB) in der Republik Moldau
BMZ (Bundesministerium für wirtschaftliche Zusammenarbeit und Entwicklung) und ekfs (Else Kröner-Fresenius-Stiftung)
- BREATHE
EU-Projekte
- UNITE4TB
TBnet-Projekte
- TBnet e. V. - Allgemeine Informationen
- Evaluation eines Escape Rooms als interprofessionelles Lehr- und Lerninstrument
- Konsensdokumente zum TB-Management bei Migranten in Europa
- TBnet-Datenbank
Niedersächsischer Verein zur Bekämpfung der Tuberkulose, Lungen- und Bronchialerkrankungen e.V.
- Biomarker-gestützte Diagnostik der Tuberkulose (detecTB)
In-house Studien
- Evaluation eines Tagebuchs zur Beurteilung des Behandlungsergebnisses bei Patient:innen mit pulmonalen Infektionen durch nichttuberkulöse Mykobakterien (NTM)
- Immunregulatorische Funktion des PD-1/ PD-L1-Checkpoint-Signalweges bei Tuberkulose
- Post-Tuberkulose-Lungenerkrankung (PTLD) in Albanien (ASTRA)
- Post-TB- und Biomarkerstudie in Moldau (TBpredict)
- CRISPR-basierte Messung von zellfreier DNA
- Komplikationsrate bei selbst-applizierter Heim-Antibiotika-Therapie bei einer Infektion mit nicht-tuberkulösen Mykobakterien (NTM)
- Vorhersage von unerwünschten Arzneimittelwirkungen in der Tuberkulosebehandlung
- DRAMATIC
- Potential von Lipoarabinomannan (LAM) für den Nachweis von Tuberkulose
S-H Gesellschaft zur Verhütung & Bekämpfung d. Tuberkulose & Lungenkrankheiten e.V.
- Access TDMetrics
- Validierung eines neuen Biomarkers (TB22) zur Diagnose und zum Therapiemonotoring der Tuberkulose
- Epigenetische und genetische Analyse der Behandlungsergebnisse bei Patientinnen und Patienten mit multiresistenter und medikamentenempfindlicher Tuberkulose
- Auswirkungen der Sputum-basierten und sequenzgesteuerten individualisierten Therapie auf die Behandlungsergebnisse bei arzneimittelresistenter TB (T3 Studie)
Borstel-Baylor Zusammenarbeit
- Analyse von M. tuberculosis-DNA aus dem Stuhl für die Diagnose von Tuberkulose
- CHIPS TB22
- Bedeutung von tNGS in eSwatini
- Siyakhula
- INSIGHT
- TB Gaps
 Über die klinische Infrastruktur (ClinTB) für die Tuberkuloseforschung im Deutschen Zentrum für Infektionsforschung (DZIF) wird die Klinische Infektiologie seit 2013 für die Entwicklung und Umsetzung neuer wissenschaftlicher Methoden zur Verbesserung der Patientenversorgung, Fort- und Weiterbildung und Entwicklung von klinischen Leitlinien gefördert.
Über die klinische Infrastruktur (ClinTB) für die Tuberkuloseforschung im Deutschen Zentrum für Infektionsforschung (DZIF) wird die Klinische Infektiologie seit 2013 für die Entwicklung und Umsetzung neuer wissenschaftlicher Methoden zur Verbesserung der Patientenversorgung, Fort- und Weiterbildung und Entwicklung von klinischen Leitlinien gefördert.
Die Universität zu Lübeck und das Forschungszentrum unterstützen seit 2014 das DZIF mit der Einrichtung der W3 Professur für Respiratory Medicine & International Health.
Unser Labor umfasst ca. 100 m2 moderne Infrastruktur zur molekularbiologischen und immunologischen Analytik. Es bestehen enge Kooperationen zum nationalen Referenzlabor für Mykobakterien und anderen wissenschaftlichen Laboren auf unserem Campus.
Das Spektrum der klinischen Forschung erstreckt sich von der Prävention über die Diagnostik zur Therapie. In grundlagenwissenschaftlichen Arbeiten untersuchen wir Mechanismen zur Resistenz und Empfänglichkeit gegenüber Infektionen mit Mycobacterium tuberculosis und wir entwickeln Methoden, um die Diagnostik der Tuberkulose zu verbessern und um Vorhersagen auf das Therapieansprechen zu machen. Gemeinsam mit Kolleginnen und Kollegen anderer Kliniken, Universitäten und Forschungsinstituten führen wir nationale und internationale Kohortenstudien durch, um in verschiedenen Populationen das Risiko für die Entwicklung einer Tuberkulose zu quantifizieren und um diagnostische Verfahren zu evaluieren, welche die Entwicklung einer aktiven Tuberkulose vorhersagen sollen.
Wir beteiligen uns an internationalen Projekten zur Entwicklung neuer Tuberkulosemedikamente und zur Identifizierung und Evaluierung von Biomarkern, die ein Therapiemonitoring und ggf. eine individualisierte Therapiedauer ermöglichen sollen.
In enger Zusammenarbeit mit Kolleginnen und Kollegen anderer Forschungsgruppen am FZB entwickeln wir Methoden für eine personalisierte Medizin der Tuberkulose. Informationen über Mutationen im Genom von Mycobacterium tuberculosis, Ergebnisse differenzierter Antibiotikaresistenzbestimmungen der Erreger und Analysen von Antibiotikakonzentrationen im Blut der Patienten setzen wir in maßgeschneiderte Therapien um. Wir koordinieren europaweite observierte Kohortenstudien, mit dem Ziel das Management der multiresistenten Tuberkulose (MDR-TB) zu verbessern.
Neben den klinischen Aspekten interessieren uns die sozialmedizinischen Umstände, welche zu Unterschieden in der Versorgungsqualität von Tuberkulosepatienten und Gesundheits-assoziierter Migration durch Tuberkuloseerkrankungen innerhalb Europas führen.


In der Tuberkuloseforschung setzten wir auf Kooperationen mit internationalen Forschungsnetzwerken, wie der Tuberculosis Network European Trialsgroup (TBnet), der Collaborative Group for the Meta-Analysis of Individual Patient Data in MDR-TB treatment sowie in EU-geförderten Projekten, aktuell ClickTB (EDCTP), Stool4TB (EDCTP) und dem Unite4TB Konsortium.
Mit einer Gruppe von erfahrenen Ärztinnen und Ärzten führt unserem Team jedes Jahr ca. 700 dokumentierte Telefonberatungen (TBinfo: 04537 188 0) rund um die Tuberkulose und um Infektionen mit Nicht-tuberkulösen Mylobakterien durch.
Zu den regelmäßigen Fort- und Weiterbildungsveranstaltungen gehört der „Kursus Klinische Tuberkulose“, der jeweils zum Ende des Frühlings in Borstel stattfindet (Anmeldungen über 04537 188 7080). Der Kurs kombiniert state-of-the-art Vorträge zum Management der Tuberkulose mit einem Update über wichtige Neuigkeiten und enthält internationale Schwerpunktthemen. Alle drei Jahre findet der Kurs für internationales Publikum auf Englisch statt.
Wir sind regelmäßig an der Erstellung nationaler und internationaler Empfehlungen, Leitlinien und Übersichtsarbeiten zur Tuberkulose, Erkrankungen durch nicht-tuberkulöse Mykobakterien und pulmonaler Mykosen beteiligt und sind in Beratergremien der Weltgesundheitsorganisation (WHO) und von Ärzte ohne Grenzen (MSF) vertreten.
Mit dem Universitätsklinikum Hamburg Eppendorf besteht eine enge Kooperation in der Lehre und klinischen Forschung.
Um die TB-Kontrolle auf globaler Ebene zu verbessern, die TB-assoziierte Morbidität zu verringern und die individuellen Krankheitsverläufe günstiger zu beeinflussen, ist ein stärker personalisierter Ansatz in der TB-Versorgung erforderlich – ein Ansatz, der genetische, klinische und umweltbedingte Faktoren des Wirts berücksichtigt, die den Verlauf der TB-Infektion und -Erkrankung prägen.
Über einen Zeitraum von drei Jahren wird an mehreren Standorten des Deutschen Zentrums für Infektionsforschung (DZIF) eine prospektive, multizentrische TB-Kohorte aufgebaut. Die Kohorte wird Patientinnen und Patienten mit pulmonaler (PTB) und extrapulmonaler TB (ePTB) umfassen, einschließlich medikamentenempfindlicher und medikamentenresistenter Fälle. Neben umfassenden klinischen Daten werden biologische Proben gesammelt und in einer zentralen Biobank gelagert.
Das Hauptziel des Projekts ist eine umfassende phänotypische Charakterisierung von TB-Patienten mittels moderner Diagnostik wie bildgebender Verfahren, Lungen- bzw. organspezifische Funktionsmessungen und laborbasierter Diagnostik. So entsteht ein einzigartiger klinischer Datensatz, der über die derzeit verfügbaren Daten aus Hochinzidenzländern hinausgeht, in denen klinische und diagnostische Kapazitäten häufig eingeschränkt sind.
Mithilfe dieser Daten sollen TB-Phänotypen charakterisiert und Risikofaktoren, auch für TB-Folgeerkrankungen, analysiert werden.


Pädiatrische Diagnosekohorte
Die Diagnose der pädiatrischen Tuberkulose ist von großer Bedeutung, da die unspezifischen Symptome bei Kindern eine große Herausforderung darstellen. Eine rechtzeitige Diagnose ermöglicht eine prompte Behandlung und verringert das Morbiditäts- und Mortalitätsrisiko.
Innovationen in der pädiatrischen Tuberkulosediagnostik sind von entscheidender Bedeutung, um diese Faktoren zu verbessern.
Maßgeschneiderte Diagnoseinstrumente können die Genauigkeit, Schnelligkeit und Zugänglichkeit der Tuberkulosediagnose bei Kindern erhöhen und so deren Ergebnisse verbessern. Innovationen, wie die Sammlung von Bazillen in der Atemluft oder die Verwendung von Stuhl und Urin, zur Verbesserung der diagnostischen Bestätigung bei Kindern können die Erkennung und die Ergebnisse verbessern.
Der Einsatz der Sequenzierung der nächsten Generation für die Prüfung der Medikamentenempfindlichkeit kann helfen, die Behandlung an das Resistenzmuster jedes Kindes anzupassen. Schließlich kann die Nachbeobachtung von Kindern mit Tuberkulose und die Analyse der Veränderungen bei Lungenfunktionstests vor und nach der Tuberkulosebehandlung dringend benötigte Erkenntnisse über Lungenerkrankungen bei Kindern nach der Tuberkulose liefern.
Therapeutic Drug Monitoring (TDM)
Im Rahmen dieses Projekts wird das Potenzial zum Einsatz von Therapeutic Drug Monitoring (TDM) in der Tuberkulose-(TB)-Behandlung an der Eastern European Study Site (EESS) des Deutschen Zentrums für Infektionsforschung (DZIF) in Rumänien untersucht. Im Mittelpunkt steht die Erhebung bestehender Strukturen sowie die Erprobung praxisnaher Strategien, die eine schrittweise und lokal angepasste Einführung von TDM ermöglichen. Zunächst wird ein umfassender Überblick über die aktuelle TDM-Landschaft in Rumänien erstellt. Dazu gehört die systematische Erfassung von Laboren, die TDM für TB-Medikamente anbieten, inklusive verfügbarer Analyte, Kosten, Probenlogistik und Transportwegen. Diese Bestandsaufnahme dient dazu, vorhandene Kapazitäten sichtbar zu machen und potenzielle regionale Partner zu identifizieren. Parallel werden gemeinsam mit rumänischen und internationalen Partner:innen institutsübergreifende Standard Operating Procedures (SOPs) entwickelt, um Arbeitsabläufe zu harmonisieren und Qualitätsstandards abzustimmen. Ergänzend werden webbasierte pharmakokinetische Modelle mit Daten der DZIF EESS TB-Kohorte getestet, um die Modelle für die jeweilige Zielgruppe zu evaluieren. Abschließend werden ausgewählte TB-Fälle in einem internationalen Expertenforum diskutiert, um klinische Empfehlungen zu erhalten, Erfahrungen auszutauschen und lokale Kompetenzen nachhaltig zu stärken.
Risk Score für TB-assoziierte Mortalität
Im Rahmen dieses Forschungsprojekts an der Eastern European Study Site wird ein klinischer Risikoscore zur Vorhersage der Mortalität bei Tuberkulose entwickelt und validiert. Ziel ist es, auf Basis einfach verfügbarer klinischer Variablen zum Zeitpunkt der Diagnose der Tuberkulose eine frühzeitige Risikostratifizierung von Patient:innen zu ermöglichen. Der Ansatz orientiert sich konzeptionell an etablierten pneumologischen Scores wie dem CRB-65-Score und überträgt dieses Prinzip auf den TB-Kontext. Entwickelt werden soll ein pragmatisches, leicht anwendbares Instrument, das insbesondere in klinischen Routine- und Ressourcensettings mit hoher Krankheitslast eingesetzt werden kann. Durch die frühzeitige Identifikation von Hochrisikopatient:innen soll der Score dazu beitragen, klinische Entscheidungsprozesse zu unterstützen, intensivierte Betreuung gezielt einzusetzen und letztlich die TB-assoziierte Mortalität in der Region zu reduzieren.
Implementierung und Evaluierung des Targeted Next-Generation Sequencing (tNGS)-Assays „FreezeTB“ für medikamentenresistente Tuberkulose in der Republik Moldau
Das Projekt „FreezeTB“ hat durch die Kombination von Geschwindigkeit, Kosteneffizienz und umfassendem Resistenzprofiling das Potenzial, die molekulare Empfindlichkeitstestung (DST) deutlich zu verbessern und eine individualisierte Behandlung von multiresistenter und Rifampicin-resistenter Tuberkulose (MDR/RR-TB) zu unterstützen.
Ziel dieser Studie ist es, den FreezeTB-Assay in der Republik Moldau, einem Land mit einer hohen Tuberkulose-Inzidenz, zu etablieren und zu evaluieren. Das Hauptziel besteht darin, FreezeTB im nationalen TB-Referenzlabor einzuführen und seine Leistungsfähigkeit bei der Erkennung von Resistenzen gegenüber First-Line-, Second-Line- sowie neuen oder wiederverwendeten Anti-TB-Medikamenten zu bewerten. Die Ergebnisse von FreezeTB werden mit den Routinediagnostikmethoden, einschließlich Xpert® MTB/RIF Ultra, Xpert® MTB/XDR und phänotypischer DST, sowie mit Illumina-basierten kommerziellen tNGS-Plattformen verglichen.
Darüber hinaus wird die operationale Durchführbarkeit untersucht, einschließlich Bearbeitungszeit, der praktischen Zeit und Fehlerraten. Die gewonnenen Erkenntnisse sollen fundierte Entscheidungen zur Integration von FreezeTB in nationale Tuberkulose-Diagnostikalgorithmen unterstützen.
Im Rahmen der Zusammenarbeit mit der Nicolae Testemitanu State University of Medicine and Pharmacy und dem Chiril Draganiuc Phthisopneumology Institute wird die Machbarkeit und der klinische Nutzen von Targeted Next-Generation Sequencing (tNGS) zur Detektion von Arzneimittelresistenzen bei multiresistenter und rifampicinresistenter Tuberkulose (MDR/RR-TB) untersucht. Während bestehende molekulare Schnelltests Resistenzen gegen essenzielle Medikamente wie Bedaquilin, Linezolid und Pretomanid nicht zuverlässig nachweisen können, ist der phänotypische Medikamentenempfindlichkeitstest (pDST) mit langen Wartezeiten verbunden, was den frühzeitigen Beginn einer wirksamen Therapie erheblich verzögert. tNGS bietet eine Lösung, indem es innerhalb von nur zwei Tagen umfassende Resistenzprofile liefert und somit schnelle, präzise und personalisierte Behandlungsentscheidungen ermöglicht. In dieser Studie werden die Resistenzprofile von MDR/RR-TB-Patient:innen mithilfe von tNGS und pDST verglichen, um die diagnostische Genauigkeit, Anwendbarkeit und Vorteile von tNGS zu bewerten. Durch die Validierung von tNGS als praxisnahes und effektives Diagnosetool wird das Projekt fundamentale Daten für die Integration dieser Technologie in die routinemäßige TB-Diagnostik liefern und damit bestehende Lücken in den derzeitigen Testmethoden schließen. Erwartete Ergebnisse umfassen eine schnellere und präzisere Resistenzbestimmung, optimierte Behandlungsergebnisse für Patient:innen sowie wertvolle epidemiologische Erkenntnisse, die zur globalen TB-Kontrolle beitragen.
Das Forschungszentrum Borstel – Leibniz Lungenzentrum, die V. N. Karazin Kharkiv National University (Ukraine) sowie weitere ukrainische Institutionen sind Teil der Klinikpartnerschaft BREATHE. Ziel der Initiative ist es, die medizinische Ausbildung und die klinischen Kapazitäten in der Atemwegs- und Infektionsmedizin in der Ukraine während des anhaltenden Krieges nachhaltig zu stärken.
Seit Beginn der russischen Invasion stehen das ukrainische Hochschul- und Gesundheitssystem unter enormem Druck. Die medizinische Lehre ist stark beeinträchtigt, während gleichzeitig die Belastung durch übertragbare und nicht übertragbare Erkrankungen zunimmt. BREATHE setzt hier an, indem es medizinische Lehre fördert, klinische Strukturen stabilisiert und Gesundheitsfachkräfte unterstützt, die unter Kriegsbedingungen arbeiten.
Das Projekt wird im Rahmen des Förderprogramms Klinikpartnerschaften durch die Deutsche Gesellschaft für Internationale Zusammenarbeit (GIZ) umgesetzt und aus Mitteln des Bundesministeriums für wirtschaftliche Zusammenarbeit und Entwicklung (BMZ) und der Else Kröner-Fresenius-Stiftung (EKFS) finanziert.
Teil des Projekts BREATHE sind eine erweiterte Online-Vorlesungsreihe zu Pneumologie und Infektionskrankheiten, wöchentliche internationale Falldiskussionen zu komplexen TB- und NTM-Fällen, einen jährlichen klinischen Fortgeschrittenenkurs in der Ukraine sowie regelmäßige Trainingsmöglichkeiten für ukrainische Ärztinnen und Ärzte im Rahmen internationaler Kurse in Borstel. Die Partnerschaft fördert den kontinuierlichen Wissensaustausch, sichert die Patientenversorgung und trägt zur langfristigen Resilienz und Erholung des ukrainischen Gesundheitssystems bei.
UNITE4TB (academia and industry united innovation and treatment for tuberculosis) ist eine öffentlich-private Partnerschaft, bestehend aus akademischen Einrichtungen, kleinen und mittleren Unternehmen (KMU), öffentlichen Organisationen und Pharmaunternehmen.
Über einen Zeitraum von sieben Jahren (2021-2028) wird das Konsortium in etwa 40 Prüfzentren auf vier Kontinenten (Europa, Asien, Afrika und Südamerika) aktiv sein, um neuartige klinische Studien der Phase 2 durchzuführen. Diese sollen einen Beitrag dazu leisten, die Entwicklung neuer TB-Medikamente und -Therapieformen zu beschleunigen.
Mit einem Finanzvolumen von 180 Millionen Euro ist UNITE4TB die größte Studie in der Geschichte der Medikamentenentwicklung der Tuberkulose.
Das Projekt verfolgt das Ziel, besser verträgliche Arzneimittelregime mit kürzerer Behandlungsdauer zu entwickeln, die zur Bekämpfung der Tuberkulose bei verschiedenen Arzneimittelresistenzmustern und Komorbiditäten eingesetzt werden können.
Über Professor Lange ist das Forschungszentrum Borstel im 4-Köpfigen Leitungsgremium von UNITE4TB vertreten. Frau Ohanna Kirakosyan aus der Forschungsgruppe Klinische Infektiologie koordiniert die Studienzentren des Konsortiums in Europa und Herr Collins Musia ist Co-Leiter des Arbeitspakets zu Biomarkern. Frau Nika Zielinski ist an der Datenanalyse und der Biomarker Evaluierung beteiligt.
Weitere Informationen finden Sie unter: https://www.unite4tb.org/
TBnet e.V. ist eine deutsche Nicht-Regierungsorganisation (NGO) mit einem Bürositz in Riga, Lettland und einem am Forschungszentrum Borstel. TBnet fördert klinisch orientierte Tuberkuloseforschung in Europa durch Austausch und Entwicklung von Ideen und Forschungsprotokollen. Es handelt sich um ein europäisches Forschungsnetzwerk, in welchem sich Ärztinnen und Ärzte sowie Forschende im Kampf gegen Tuberkulose zusammengefunden haben und welches darauf abzielt, die Qualität der Versorgung von Tuberkulosepatientinnen und -patienten zu fördern, indem es sich mit gesundheitlichen Ungleichheiten befasst, multizentrische klinische Studien durchführt und europäische Ärztinnen und Ärzte sowie Wissenschaftlerinnen und Wissenschaftler ausbildet.
In den vergangenen Jahren hat TBnet wichtige Beiträge zur Erforschung der Tuberkulose auf den Gebieten der Epidemiologie, Prävention, Diagnostik und Therapie geliefert. Eine Liste mit den TBnet-Publikationen finden Sie hier.
Aktuell verzeichnet TBnet über 650 aktive Mitglieder aus mehr als 50 Ländern (Stand Mai 2024). Laufende Studien befassen sich unter anderem mit der Verbesserung der Methoden zur Diagnostik und Therapieüberwachung.
Namentlich handelt es sich hierbei um Harn-Metabolomanalysen, der Evaluation eines miniMDR TB Tests und der Verbesserung der diagnostischen Qualität des Interferon-Gamma-Release-Assay (IGRA) in immunsupprimierten Patientinnen und Patienten. Allgemeinere Studien befassen sich mit dem TB-Management in organtransplantierten Patientinnen und Patienten oder mit der Fragestellung, wie stark der Medikamentenspiegel im Blut spezifische Therapiemarker beeinflusst.
Zur Ausbildung zählt die TBnet Academy, die sich an junge Wissenschaftlerinnen und Wissenschaftlern sowie Ärztinnen und Ärzte richtet, um ihnen ein umfangreiches Wissen zu vermitteln. In den letzten Jahren fand die TBnet Academy in Athen, Tbilisi und Riga statt.
TBnet Mitgliedstreffen finden jährlich am Freitag vor der ERS Konferenz statt. Dort gibt es Gelegenheit sich auszutauschen, den Stand der Projekte vorzustellen, und zu diskutieren und neue Forschungen anzustoßen.
Die Mitgliedschaft steht jedem offen, der einen gemeinnützigen Beitrag zur Tuberkuloseforschung leisten möchte. TBnet erhebt keinen Mitgliedsbeitrag.
Ein Zweig des TBnets ist das Nontuberculous Mycobacteria Network (NTMnet). Ursprünglich gehörte auch das Pediatric Tuberculosis Network (pTBnet) zum TBnet, ist aber inzwischen eigenständig.
Hervorgegangen ist dieses Netzwerk 2011 aus der Klinischen Infektiologie des Forschungszentrums Borstel. Den aktuellen Vorsitz hält Dr. Liga Kuksa aus Riga in Lettland inne. Das TBnet Sekretariat am Forschungszentrum Borstel wird von Anne Oleischeck (aoleischeck@fz-borstel.de) geleitet.
Dieses Projekt untersucht den Einsatz eines Escape Rooms als innovative Lehrmethode innerhalb der TBnet Academy, einem internationalen und multidisziplinären Fortbildungsprogramm mit Schwerpunkt auf Diagnose, Behandlung und Management von Tuberkulose (TB) und nichttuberkulösen Mykobakterien (NTM). Escape Rooms kombinieren Problemlösung, Teamarbeit und realistische klinische Szenarien, um die Teilnehmenden aktiv einzubinden und sinnvolles Lernen jenseits traditioneller Vorlesungen zu ermöglichen. Die Studie evaluiert die Akzeptanz, Durchführbarkeit und den wahrgenommenen pädagogischen Wert eines TB-spezifischen Escape Rooms mit Lernenden und Lehrenden aus verschiedenen Ländern und mit unterschiedlichem beruflichem Hintergrund. Im Rahmen eines qualitativen, multizentrischen Studiendesigns werden die Teilnehmenden eingeladen, ihre Erfahrungen in halbstrukturierten Online-Interviews zu teilen. Die Analyse konzentriert sich auf das Engagement, die Wissensintegration, das Vertrauen in TB-Konzepte sowie die Entwicklung von Team- und Kommunikationsfähigkeiten. Durch die Erfassung der Perspektiven der Teilnehmenden möchte dieses Projekt Lehrende und Institutionen bei der Reflexion über innovative Lehransätze unterstützen. Die Ergebnisse werden die zukünftige Nutzung interaktiver, kollaborativer Lernformate in internationalen Fortbildungen und übergreifenden Initiativen zur medizinischen Ausbildung beeinflussen.


Die weltweite Migration hat in den letzten Jahrzehnten aufgrund von Kriegen, Konflikten, Verfolgung, Menschenrechtsverletzungen und Naturkatastrophen, aber auch aufgrund von Arbeits- oder Studienmöglichkeiten zugenommen. Das Tuberkuloserisiko von Migrantinnen und Migranten hängt von den Gründen für die Migration, dem sozioökonomischen Status, der Art der Reise und dem Tuberkuloserisiko im Transitland sowie der Gesundheitsversorgung im Herkunfts- und im Aufnahmeland ab.
Trotz Fortschritten bei der Tuberkuloseversorgung von Migrantinnen und Migranten und neuen Behandlungsstrategien beruhen Entscheidungen über die Behandlung der Betroffenen häufig auf Expertenmeinungen und nicht auf klinischen Erkenntnissen.
Diese Dokumente fassen den aktuellen Wissensstand über TB-Diagnose, TB-Behandlungsstrategien bei Migranten, MDR-TB bei Migranten und HIV/TB-Koinfektion bei Migranten, die nach Europa kommen, zusammen. Die Studien wurden durch eine Meta-Analyse zusammengefasst, wenn dies angemessen war, ansonsten wurde eine narrative Zusammenfassung verwendet. Auf der Grundlage einer systematischen Überprüfung wurden Konsensempfehlungen von Expertinnen und Experten zu allen Aspekten der Migrantenversorgung gegeben.
Die Entwicklung einer REDCap-Datenbank (Research Electronic Data Capture) für TBnet-Forschungsprojekte ist wichtig, um den Prozess der Datenerfassung und -verwaltung zu zentralisieren, und bietet anpassbare Formulare für die Dateneingabe, die ein effizientes und standardisiertes Datenmanagement erleichtern. Ein funktionsfähiges Datenerfassungs- und -verwaltungssystem bietet TBnet die Möglichkeit, Forschungsdaten aus verschiedenen Projekten gemeinsam zu nutzen und eine leistungsfähigere Plattform für Anträge und Veröffentlichungen zu haben.
DetecTB, eine Studie zur Biomarker-gestützten Diagnostik der Tuberkulose, untersucht nicht-invasive diagnostische Methoden zur Identifizierung von TB-Patient:innen. Ziel ist es, Biomarker aus Blut, Urin, Stuhl und Sputum zu identifizieren, die eine zuverlässige TB-Diagnose ermöglichen, insbesondere bei Patient:innen ohne Sputumproduktion oder mit extrapulmonaler TB.
Im Universitätsklinikum Hamburg-Eppendorf werden Patient:innen mit TB-Verdacht sowie Kontrollpersonen mit anderen pulmonalen Infektionen in die Studie eingeschlossen. Es erfolgt eine einmalige Entnahme verschiedener Biomaterialien, die mit modernen Verfahren wie mRNA-Signaturen, zellulärer Immunologie, PATHFAST-LAM, EclLAM, CRISPR-Cas, Stuhl-PCR und Xpert MTB-HR analysiert werden. Die Machbarkeit und diagnostische Wertigkeit dieser Ansätze werden systematisch evaluiert.
Hauptziel ist die Identifikation neuer Biomarker oder Biomarker-Kombinationen, die eine nicht-invasive, schnelle und präzise TB-Diagnose ermöglichen. Sekundäre Ziele umfassen Vergleiche zwischen pulmonaler und extrapulmonaler TB, geschlechtsspezifische Unterschiede und Zusammenhänge mit Krankheitsverlauf und Prognose.
Die prospektive monozentrische Beobachtungsstudie umfasst 120 Patient:innen, deren Teilnahme keinen direkten medizinischen Nutzen bietet, jedoch langfristig zur Entwicklung verbesserter TB-Diagnostik beitragen kann. Daten und Proben werden pseudonymisiert gespeichert, eine Weitergabe erfolgt nur in anonymisierter Form. Die Ergebnisse könnten dazu beitragen, invasive diagnostische Maßnahmen zu reduzieren und eine frühzeitigere Therapieeinleitung zu ermöglichen.
Im Rahmen eines multizentrischen, prospektiven Forschungsprojekts wird die Rolle eines Symptomtagebuchs bei pulmonalen Infektionen durch nicht-tuberkulöse Mykobakterien (NTM) untersucht. Die Studie wird in zahlreichen spezialisierten Zentren in ganz Europa durchgeführt und ist im Rahmen des Netzwerks NTMnet angesiedelt. Ziel des Projekts ist es, systematisch zu erfassen, wie sich Symptome im Krankheits- und Therapieverlauf verändern und in welchem Ausmaß diese mit mikrobiologischen und radiologischen Befunden korrelieren. Durch den Einsatz eines standardisierten Symptomtagebuchs soll untersucht werden, ob patientenberichtete Outcomes als frühe Marker für Krankheitsprogression oder Therapieansprechen genutzt werden können. Langfristig soll NTM Diary dazu beitragen, das Monitoring von NTM-Erkrankungen zu verbessern und patientenzentrierte Endpunkte stärker in klinische Entscheidungsprozesse zu integrieren.
Immuncheckpoints sind regulatorische Signalwege des Immunsystems, die eine zentrale Rolle in der Kontrolle, Modulation und Aufrechterhaltung der Immunantwort spielen. Sie tragen dazu bei, überschießende Immunreaktionen zu verhindern und die immunologische Homöostase zu sichern. Zu den am besten charakterisierten Immuncheckpoint-Molekülen zählen das Programmed Cell Death Protein 1 (PD-1) und sein Ligand PD-L1, welche an der Regulation der T-Zell-Aktivierung, -Proliferation und -Effektorfunktion beteiligt sind.
Die PD-1/PD-L1-Signalwege stellen immunregulatorische Mechanismen bei chronischen Infektionskrankheiten wie der Tuberkulose dar. Eine persistierende Antigenexposition kann zu einer verstärkten Expression von PD-1 und PD-L1 führen, was mit funktionellen Veränderungen von T-Zellen sowie einer eingeschränkten antimykobakteriellen Immunantwort assoziiert ist. Gleichzeitig stellt diese immunregulatorische Achse einen wichtigen Mechanismus zur Begrenzung entzündlicher Gewebeschäden dar.
Ziel dieser Arbeit ist es, die immunologischen Mechanismen der Krankheitsprogression zu untersuchen, potenzielle immunologische Biomarker und therapeutische Ansatzpunkte im Kontext der Tuberkulose zu identifizieren.
Post-Tuberkulose-Lungenerkrankung ist eine häufige, aber oft unterschätzte Folge einer überstandenen Tuberkuloseerkrankung. Weltweit leben etwa 150.000 Millionen Menschen, die eine Tuberkulose überlebt haben, viele von ihnen jedoch mit langfristigen gesundheitlichen Beeinträchtigungen, die durch die Schädigung der Lunge während der Tuberkulose entstehen. Schätzungen zufolge entwickeln etwa 50 % der Überlebenden eine dauerhafte Einschränkung ihrer körperlichen Leistungsfähigkeit und leiden unter chronischen Atemwegserkrankungen. Diese Folgeerkrankung stellt eine ernsthafte gesundheitliche Herausforderung dar und kann die Lebensqualität erheblich beeinträchtigen. Leider wird PTLD bisher oft nicht ausreichend diagnostiziert und behandelt.
Albanien ist nach wie vor stark von Tuberkulose betroffen, und bisher wurden die genauen Zahlen der Menschen, die an PTLD leiden, im Land nicht systematisch erfasst. Gemeinsam mit Ärztinnen und Ärzten des Nationalen Krankenhauses für Lungenerkrankungen in Tirana werden deshalb in einer prospektiven Beobachtungskohortenstudie 100 Tuberkulosepatienten 6 bis 30 Monate nach dem Ende ihrer Tuberkulosetherapie untersucht. Erfasst werden Beeinträchtigungen der Lungenfunktion, Belastungsintoleranz und depressive Symptome, so daß das Ausmaß von PTLD in Albanien genauer analysiert werden kann und gezielte Maßnahmen zur Verbesserung der Lebensqualität von Tuberkuloseüberlebenden entwickelt werden. Die ASTRA-Studie ist die erste umfassende Untersuchung von PTLD in Albanien.
Die Ergebnisse der Studie sind nicht nur für Albanien von Bedeutung, sondern könnten auch als Modell für andere Länder dienen, die vor ähnlichen Herausforderungen in der posttuberkulösen Versorgung stehen.

Ziel der TBpredict Studie ist es, neue molekulare und immunologische Marker zu evaluieren, die eine frühzeitige und präzisere Beurteilung des Therapieerfolgs der multiresistenten Tuberkulose ermöglichen. Dazu gehören MBLA- und LAM-Messungen im Sputum sowie RNA-Sequenzierung im Blut. In der Studie werden diese Verfahren erstmals gleichzeitig getestet, sodaß ein Vergleich der Methoden möglich ist. Zudem werden auch Lungenfunktionstests durchgeführt und körperliche Leistungsparameter untersucht, um Vorhersagen für eine Leistungsminderung im Anschluss an die Ausheilung der Infektionskrankheit treffen zu können. Etwa 50% der Tuberkulosepatient:innen sind von einer Post-Tuberkulose-Erkrankung betroffen. Sie haben eine anhaltende eingeschränkte Leistungsfähigkeit in der Folge von Zerstörungen des Lungengewebes durch die Tuberkulose, auch wenn die Infektionskrankheit bereits überwunden wurde.
Die Republik Moldau ist ein Hochinzidenzgebiet für Antibiotika-resistente Tuberkulose weltweit. Das Projekt ist Teil einer langjährigen engen wissenschaftlichen Zusammenarbeit zwischen dem Forschungszentrum Borstel, der Nicolae Testemitanu State University of Medicine and Pharmacy (USMF) in Chișinău und dem Institut für Pneumologie in Chișinău.
In der Studie werden in Chișinău prospektiv 50 Patienten mit Rifampicin-resistenter oder multiresistenter Tuberkulose (RR-/ MDR-TB) eingeschlossen. An fünf Zeitpunkten in der Frühphase der TB-Therapie, aber auch 12 und 18 Monate nach Therapiebeginn werden umfangreiche Daten erhoben.
Die Studie zum CRISPR basierten Nachweis von Tuberkulose (TB) untersucht die diagnostische Aussagekraft eines Assays zum Nachweis des mobilen genetischen Elements IS 6110 im Blut. Der Goldstandard für den Nachweis von TB ist die kulturelle Anzucht der Mykobakterien aus Sputum. Dieses Verfahren ist kosten- und zeitintensiv. Bei Patienten, bei denen kein Sputum gewonnen werden kann, z.B. bei Kindern oder extrapulmonaler TB, ist eine Diagnose so nicht möglich. Bei bestehender HIV-Koinfektion liefert Sputum häufig falsch negative Ergebnisse. Der Nachweis durch CRISPR-abhängige Fluoreszenz aus Blutproben ist in wenigen Stunden möglich. In ersten Studien zeigt der Test eine gute diagnostische Aussagekraft auch bei extrapulmonaler TB, Kindern und HIV-Koinfektion.
Primäres Ziel dieser Studie ist die Validierung des Tests für den sputumfreien Tuberkulose-Nachweis. Anhand von Proben aus Biomarker-Studien soll die Eignung des Assays zur Verlaufskontrolle evaluiert werden. CRISPR-basierte Nachweisverfahren haben aufgrund ihrer Eigenschaften das Potential, in Point-of-Care Devices implementiert zu werden, sodass die Validierung dieser Assays einen wesentlichen Beitrag zur schnelleren und dezentralen Tuberkulosediagnostik leisten könnte. Forschende der Tulane University (New Orleans, Louisiana) haben ein Lab-in-Tube Device entwickelt mit dem der Nachweis von zellfreier Tuberkulose-DNA aus Sputum in 2 Stunden möglich ist. Eine Evaluation des Lab-in-Tube Devices ist für die nahe Zukunft geplant.
Das OPAT-NTM-Projekt befasst sich mit der Anwendung und Bewertung von sogenannter sOPAT (self-administered Outpatient Parenteral Antimicrobial Therapy) bei Infektionen mit nicht-tuberkulösen Mykobakterien (NTM). Im Mittelpunkt steht die Frage, wie praktikabel und sicher eine langfristige intravenöse Antibiotikatherapie außerhalb des stationären Settings durchgeführt werden kann.
Wir analysieren dazu die klinischen Daten von 26 Patient:innen der Lungenklinik Borstel mit pulmonalen und nicht-pulmonalen Infektionen durch unterschiedliche Mykobakterienspezies (u. a. M. avium, M. chimaera, M. abscessus, M. chelonae). Ein zentrales Ziel ist es, die Dauer und Zusammensetzung der eingesetzten Antibiotikaregime darzustellen und die Gründe für Therapieabbrüche oder Modifikationen zu erfassen. Neben der Wirksamkeit werden vor allem Nebenwirkungen, Komplikationen des Portsystems sowie der Umgang mit unerwünschten Ereignissen untersucht.
Insgesamt wollen wir zur Evidenzgrundlage für ein Therapiekonzept beitragen, das Patient:innen mehr Autonomie ermöglicht und gleichzeitig die Langzeitbehandlung schwer therapierbarer Infektionen unterstützt.
Unerwünschte Arzneimittelwirkungen können die Behandlung einer Tuberkulose erschweren und für die Erkrankten mit einer Einschränkung der Lebensqualität einhergehen. Bisher sind nicht bei allen Medikamenten die zugrundeliegenden Mechanismen bekannt, so dass unerwünschte Arzneimittelwirkungen bis heute nicht vollends verhindert werden können.
Ziel dieses Projektes ist deshalb die Identifizierung und Validierung von Gensignaturen unter Verwendung von machine-learning Algorithmen zur Vorhersage von schweren unerwünschte Arzneimittelwirkungen vor Beginn der Tuberkulosebehandlung. Hier bieten sich insbesondere transkriptombasierte Signaturen an. Außerdem sollen mittels systembiologischer Bestimmung von Genen und Pathways mögliche Erklärungsansätze für die Entwicklung von schweren unerwünschten Arzneimittelwirkungen generiert werden. Dies wäre ein möglicher Grundstein für weiterführende Forschung, welche das Ziel verfolgt, die Mechanismen besser zu verstehen und ihnen gegebenenfalls präventiv gegensteuern zu können.
Mithilfe dieser Arbeit ist es hoffentlich in naher Zukunft möglich, ein erhöhtes Risiko für schwere unerwünschte Arzneimittelwirkungen bereits vor Medikamentenexposition zu erkennen und damit einen Beitrag zur personalisierten Medizin in der Tuberkulosebehandlung zu leisten.
In einem Teilprojekt konnte bereits die Genexpression von Suprabasin (SBSN) als potenzieller Biomarker für die Vorhersage von schweren Linezolid-assoziierten Neuropathien identifiziert werden.
DRAMATIC ist eine prospektive, dauer-randomisierte, teilweise verblindete Phase-2-Studie. Sie soll
1) eine genaue Beziehung zwischen der Therapiedauer und dem Anteil erfolgreicher Therapieergebnisse nachweisen,
2) bestimmen, welche Behandlungsdauern des oralen experimentellen Regimes so effektiv sind wie das derzeit empfohlene (aber kürzlich zurückgestufte) Injectables-enthaltende Regime von 9-11 Monaten und
3) das Sicherheitsprofil des experimentellen Regimes ermitteln.
Die Studie randomisiert 220 Teilnehmer, darunter Erwachsene (18 Jahre oder älter) und Kinder (12-17 Jahre alt) mit MDR-TB, in 16, 24, 32 oder 40 Wochen Behandlung mit einem oralen experimentellen Regime aus 5 Medikamenten (Bedaquilin, Delamanid, Linezolid, Levofloxacin und Clofazimin).
Durch die vier experimentellen Behandlungsdauern kann die Wirksamkeit mehrerer Therapiedauern geschätzt werden, und die Wahrscheinlichkeit, die kürzeste effektive Behandlungsdauer zu finden, wird maximiert. Mit diesem Studiendesign wird vermieden, dass die gewählte Dauer entweder zu kurz (und damit nicht ausreichend effektiv) oder zu lang (und damit mit übermäßiger Toxizität verbunden) ist. Durch die Nachverfolgung der Patienten zur Beobachtung von Rückfällen werden wichtige Informationen gesammelt für die optimale Behandlungsdauer in einer großen Phase-3-Studie.
Eine Vielzahl biologischer Marker (u.a. Stoffwechselprodukte, Proteine, RNA im Sputum, Blut oder Urin) werden analysiert, um neue Alternativen zu traditionellen kulturbasierten Bestimmungsmethoden für die bakterizide Aktivität eines Medikaments oder einer Medikamentenkombination zur Vorhersage von Therapieversagen und Rückfällen zu finden.
Die Studie wird an Studienzentren in den Philippinen und Vietnam durchgeführt und von der University of California (UCS) und Novartis, Otsuka und Pfizer als Industriepartner gesponsert. Es sind Wissenschaftler aus den USA (Boston University, University of Colorado, UCS, Harvard), den Philippinen, Vietnam und Borstel beteiligt.
Falls bis zum Abschluss der DRAMATIC-Studie ein neues und effektiveres Standardregime verwendet wird, kann DRAMATIC dennoch eine Dauer des experimentellen Regimes identifizieren, die non-inferior zum neuen Standardregime ist. Dies wird einen zügigen Übergang zu einer bestätigenden Phase-3-Studie erleichtern.
Die Diagnose einer Tuberkulose stellt insbesondere bei vulnerablen Patientengruppen wie Kindern, älteren Menschen oder HIV-Infizierten eine große Herausforderung dar. Der aktuelle Goldstandard der Tuberkulosediagnostik ist der kulturelle Nachweis von Mycobacterium tuberculosis in Sputumproben. Diese Methode setzt allerdings voraus, dass Patienten ausreichend Sputum produzieren können, was gerade bei Kindern, älteren Menschen oder immungeschwächten Patienten häufig problematisch ist. Lipoarabinomannan (LAM), das von Mycobacterium tuberculosis freigesetzt wird und in Körperflüssigkeiten nachweisbar ist, bietet die Möglichkeit einer nicht-invasiven und schnelleren Diagnosestellung.
Der Electrochemiluminescence LAM Research Assay (EclLAM, MSD, Rockville, Maryland, USA) ist ein hochsensitiver Immunoassay, der eine ELISA-ähnliche Plattform mit elektronischer Lumineszenzdetektion nutzt, um selbst geringste LAM-Konzentrationen präzise zu quantifizieren.
Ziel dieses Forschungsprojekt ist es, die diagnostische Genauigkeit der LAM-basierten Nachweismethoden in Urinproben zur Diagnose der TB zu evaluieren.
In Kooperation mit der Arbeitsgruppe Klinische Pharmakologie der Universität Hamburg und dem Department of Pharmaceutical Biosciences der Uppsala University entwickeln wir im Projekt "AccessTDMetrics" ein innovatives Tool zur Optimierung der Tuberkulose-Behandlung mit Zweitlinien-Medikamenten. Ziel ist die Bereitstellung eines leicht zugänglichen Werkzeugs für das pharmakokinetische Modelling der Medikamente.
Durch Messung der Antibiotika-Konzentration im Blut von Patientinnen und Patienten (Therapeutic Drug Monitoring, TDM) können Medikamenten-Dosierung an die Resistenz von Bakterien und an das Nebenwirkungs-Risiko angepasst werden. Dadurch können Zweitlinien-Medikamente effektiver eingesetzt und Nebenwirkungen vermieden werden. Es fehlt jedoch bisher ein einfach zugängliches Tool, das die gemessenen Konzentrationen anhand von pharmakokinetischen Modellen interpretieren und Ärztinnen und Ärzten bei der Dosierungsentscheidung helfen kann.
Mit großzügiger Unterstützung durch die Schleswig-Holsteinische Gesellschaft zur Verhütung und Bekämpfung der Tuberkulose und der Lungenkrankheiten e.V. können wir im Rahmen des Projekts pharmakokinetische Kohortendaten generieren und bestehende pharmakokinetische Modelle anhand der Daten validieren. Die besten Modelle werden anschließend in die Web-Applikation TDMx.eu der Universität Hamburg integriert, um Ärztinnen und Ärzte bei der Dosierung von Tuberkulose-Medikamenten effektiver zu unterstützen.


 Am Forschungszentrum Borstel wurde ein neuer Biomarker (TB22) identifiziert, der die Individualisierung der Dauer der Tuberkulosetherapie ermöglicht. Hierfür wurde eine Signatur aus RNA Sequenzen im peripheren Blut von Patientinnen und Patienten identifiziert. Zur weiteren Validierung gibt es über eine Beteiligung an dem EU-Projekt Zugang zu Blutproben von sehr gut charakterisierten Tuberkulosepatientinnen und -patienten aus Mosambik, Uganda und eSwatini.
Am Forschungszentrum Borstel wurde ein neuer Biomarker (TB22) identifiziert, der die Individualisierung der Dauer der Tuberkulosetherapie ermöglicht. Hierfür wurde eine Signatur aus RNA Sequenzen im peripheren Blut von Patientinnen und Patienten identifiziert. Zur weiteren Validierung gibt es über eine Beteiligung an dem EU-Projekt Zugang zu Blutproben von sehr gut charakterisierten Tuberkulosepatientinnen und -patienten aus Mosambik, Uganda und eSwatini.
Die TB22-Signatur wird auf Transkriptomdaten angewandt, um festzustellen, ob sie Tuberkulose bei afrikanischen Kindern und PLHIV zu Beginn der Behandlung genau diagnostizieren kann. Außerdem wird die Dynamik von TB22 während der Behandlung bewertet, um festzustellen, ob das Modell den Zeitpunkt, an dem der Patient eine rückfallfreie Heilung erreicht hat, genau vorhersagen kann.
Transkriptomdaten können auch die Entdeckung neuer, noch nicht bekannter RNA-Signaturen ermöglichen, z. B. Signaturen zur Vorhersage des Krankheitsverlaufs, zur Erkennung aktiver Tuberkulose, zur Unterscheidung zwischen Tuberkulose und nicht-tuberkulösen Lungenerkrankungen, zur Überwachung des Ansprechens auf die Behandlung oder zur Vorhersage eines Tuberkuloserezidivs in frühen Stadien.
In einer longitudinalen Kohorte wurden zu verschiedenen Zeitpunkten der Therapie Proben entnommen, welche zur Gewinnung von DNA sowie epigenetischen Daten dienen. Des Weiteren wurden klinische Daten zu Krankheitsschwere in Form von Kulturdaten und bildgebenden Verfahren, Behandlungsergebnisse, Medikation sowie etwaige Nebenwirkungen zusammengetragen. Mithilfe dieser Daten soll ermittelt werden, ob und welche TB-relevanten RNA-Expressionen, welche in vorangegangenen Studien identifiziert wurden, auf Mutationen der DNA oder auf epigenetische Störungen zurückzuführen sind, um somit Rückschlüsse auf eine ergänzende epigenetische oder immunmodulatorische Therapie ziehen zu können. Darüber hinaus wird untersucht, ob es eine Korrelation von epigenetischen Störungen und den klinischen Ausprägungen, den Therapieergebnissen und der Immunzellaktivität gibt oder mit bereits existierenden Konzepten der personalisierten TB-Therapie (z.B. Endotypen). Des Weiteren wird untersucht, ob das epigenetische Profil durch bestimmte, in der TB-Therapie verwendete Medikamente, eine Veränderung erfährt.
Antibiotikaresistenzen erschweren die Behandlung der Tuberkulose in zunehmendem Maße. Kulturelle Verfahren zur Ermittlung von Antibiotikaresistenzen sind aufwendig und langwierig. In der Regel dauert es mehrere Monate die zwischen der Diagnosestellung einer Tuberkulose und dem Erhalt eines Antibiogramms vergehen. Neue Methoden der Gensequenzierung erlauben eine rasche und umfangreiche Information über Mutationen im Genom von Tuberkulosebakterien, die mit Antibiotikaresistenzen assoziiert sind. Diese molekularen Vorhersagen von Antibiotikaresistenzen mittels gezielter Sequenzierungstechnologien (t-NGS) werden seit Sommer 2023 offiziell von der WHO für Vorhersagen von Antibiotikaresistenzen und die Zusammenstellung von Therapieregimen empfohlen. Das Forschungszentrum Borstel ist an diesem Prozess und der Vorbereitung der WHO-Empfehlungen wesentlich beteiligt.
Ob die Behandlungsergebnisse von betroffenen Patientinnen mit einer multiresistenten Tuberkulose (MDR-TB) tatsächlich durch Verwendung der neuen Technologien verbessert werden können ist zwar plausibel, wurde aber bislang noch nie in einer klinischen Studie belegt.
Das Forschungszentrum Borstel ist eine strategische Partnerschaft mit der Universität in Kapstadt, Südafrika eingegangen, um diese und andere Fragen gemeinsam zu adressieren.
Unsere Forschergruppe unterstützt Kollegen von der Universität Kapstadt (Prof. Dr. Keertan Dheda, MD PhD) in der T3 Studie 2024, bei der der Einfluss der tNGS Technologie auf die Behandlungsergebnisse von PatientInnen mit einer MDR-TB in Südafrika untersucht wird. Die ersten Patienten wurden im Frühjahr 2024 eingeschlossen.
Der übergeordnete Endpunkt der Studie besteht darin, den Einfluss von tNGS-basierten Therapieregimen auf die Behandlungsergebnisse von Patienten mit einer MDR-TB zu bestimmen.
Primärer Endpunkt der Phase 1:
Anteil der Patienten, bei denen innerhalb von 14 Tagen nach der Diagnose einer Rifampicin-resistenten Tuberkulose in jeder Gruppe eine Behandlung mit ≥4 wahrscheinlich wirksamen Medikamenten eingeleitet wurde (n=120).
Primärer Endpunkt der Phase 2:
Rate der ungünstigen Ergebnisse 6 Monate nach Behandlungsbeginn in jeder Gruppe (n=240 einschließlich der Patienten der Phase 1).
Primärer Endpunkt der Phase 3:
Rate der ungünstigen Ergebnisse in jeder Gruppe 12 Monate nach Beginn der Behandlung (n=300 einschließlich der Patienten in Phase 2).
Der Xpert MTB/RIF Ultra ist ein molekularer Schnelltest im Kartuschenformat, der erstmals 2017 als Upgrade des Xpert MTB/RIF-Tests zur Diagnose von Tuberkulose eingeführt wurde.
Spurenpositive Ergebnisse können den Nachweis von Rest-DNA von früherer Tuberkulose, eine Kreuzkontamination der Probe oder einen Laborfehler darstellen. Gleichzeitig können sie auch eine Möglichkeit sein, eine aktive Tuberkuloseerkrankung in einem frühen Stadium zu erkennen. Stuhl ist eine klinische Probe, die von der WHO für die Diagnose von Tuberkulose bei Kindern empfohlen wird und für Erwachsene zunehmend an Bedeutung gewinnt. Wir analysieren die Ergebnisse von Stuhlproben in einer Fall-Kontroll-Studie mit TB-Patientinnen und Patienten, die mit gesunden Kontrollpersonen gepaart wurden.
Am Forschungszentrum Borstel wurde ein Transkriptom-Modell zur Untersuchung des Therapieansprechens entwickelt. Dieses Modell nutzt die Reaktion des menschlichen Körpers auf eine Infektion mit tuberkulösen Mykobakterien, um festzustellen, ob jemand infiziert ist. Auch konnte damit sehr genau bestimmt werden, wann jemand lange genug mit Antibiotika behandelt wurde, um geheilt zu sein. So könnte die Behandlung eines Tages individuell für jede:n Patient:In angepasst werden.
Das auf 22 Genen basierende Modell (kurz: TB22) kann aber auch zur Diagnostik benutzt werden. Das ist besonders bei Kindern interessant, da hier viele Labormethoden eine Tuberkulose-Erkrankung oft nicht erkennen. Es fehlt dann der eindeutige Nachweis von M. tuberculosis, die Diagnose kann so nur klinisch gestellt werden. Ziel dieses Forschungsprojektes ist, zu überprüfen, ob das TB22 Modell bei Kindern oder Menschen mit HIV-Infektion bei der Diagnostik helfen kann. In enger Zusammenarbeit mit dem Baylor College of Medicine, Houston, USA haben wir RNA-Proben von tuberkulose-erkrankten Kindern aus Eswatini (im südlichen Afrika) genommen. Aktuell sind die ersten Proben auf dem Weg nach Borstel und wir beginnen mit den Messungen für das Transkriptom-Modell TB22.
Hintergrund
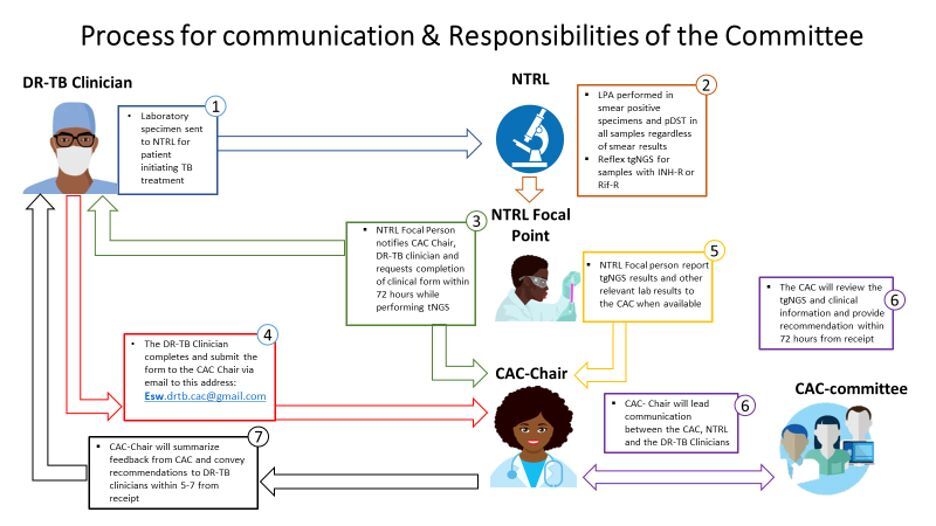
Nationale Erhebungen zur Tuberkulose-Arzneimittelresistenz, die 2009/2010 und 2018 in Eswatini durchgeführt wurden, zeigten die Übertragung eines rifampicinresistenten (RR) Mycobacterium tuberculosis complex (Mtbc)-Stammes, der die rpoB I491F-Mutation trägt. Die Prävalenz dieses Stammes stieg von 30 % bei der Erhebung 2009/2010 auf 58 % bei der Erhebung 2018. Die derzeitige kommerzielle molekulare Schnelldiagnostik (MRD) und die phänotypische Medikamentenempfindlichkeitsprüfung (pDST) durch MGIT (Mycobacteria growth indicator tube) erkennen die durch diese Mutation verursachte RR nicht, was zu einer diagnostischen Lücke und einer suboptimalen TB-Behandlung führt. Als Reaktion darauf führte das Nationale Tuberkuloseprogramm von Eswatini in Zusammenarbeit mit dem Global TB Program des Baylor College of Medicine und anderen wichtigen Partnern von November 2021 bis Dezember 2022 ein Pilotprojekt durch, bei dem die gezielte Sequenzierung der nächsten Generation (tNGS) für die molekulare Arzneimittel-Empfindlichkeitsprüfung (mDST) von klinischen Mtb-Stämmen eingesetzt wurde. Ein klinischer Beratungsausschuss (Clinical Advisory Committee, CAC) mit Fachleuten aus den Bereichen Klinik, Labor und öffentliches Gesundheitswesen wurde gebildet, um die Optimierung der Behandlung von Patienten mit zusätzlichen tNGS-Ergebnissen anzuleiten.
Vorläufige Ergebnisse
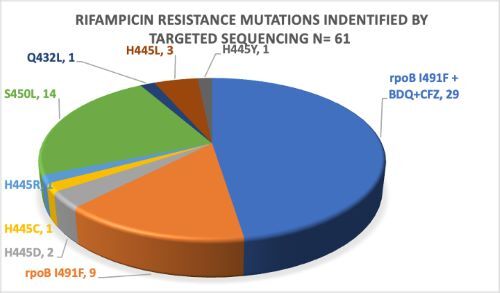
Im Zeitraum von November 2021 bis Dezember 2022 wurden insgesamt 85 Proben sequenziert und 61 RR-Stämme identifiziert. Davon wiesen 38 (62 %) eine rpoB I491F-Mutation auf, wobei 29 (76 %) der rpoB I491F-Stämme eine zusätzliche Resistenz gegen Bedaquilin und Clofazimin aufwiesen. Ausgehend von diesen Ergebnissen wurden 40 Patientinnen und Patienten weiterverfolgt, und ihre klinischen Berichte wurden dem CAC zur Behandlungsberatung vorgelegt.
Schlussfolgerung
Ohne den Einsatz von tNGS bei der DR-TB-Diagnose in Eswatini wären 38/61 (62 %) der MDR/RR-TB-Patienten mit rpoB I491F-Mutation und 29/38 (76 %) mit zusätzlicher Bdq- und Cfz-Resistenz übersehen worden. Auf der Grundlage der tNGS-Ergebnisse und der CAC-Empfehlungen profitierten 14/40 (35 %) der Patienten von optimierten Behandlungsschemata. Durch die Anpassung der Behandlung erzielten 10/14 (71 %) der Patienten, deren klinischer Zustand sich unter dem ursprünglichen Regime verschlechterte ("Therapieversagen"), erfolgreiche Behandlungsergebnisse.
Empfehlung
Der Nachweis der I491F rpoB-Mutation und von Arzneimittelresistenzmutationen für neue und neu entwickelte Arzneimittel sollte bei der Entwicklung von MRDs berücksichtigt werden. Es werden neuere Arzneimittel benötigt, da die Resistenz gegen Bedaquilin immer häufiger auftritt.
Für weitere Informationen wenden Sie sich bitte an die leitende Labortechnologin des Eswatini Health Laboratory Services, Frau Sindisiwe Dlamini, unter sindydlamini36@yahoo.com
Das gemeinsame HIV/AIDS-Schulungsprogramm des Baylor Colleges of Medicine Global TB Program, Siyakhula (was auf siSwati "wir wachsen" bedeutet) - „Growing HIV/TB Research Knowledge for Growing Healthy Kids in Eswatini". Es soll die Forschungskapazitäten in Eswatini stärken, die sich auf HIV/AIDS und TB bei Kindern konzentrieren. Dieses Ziel soll erreicht werden durch:
- Nutzung des vorhandenen pädiatrischen HIV-Fachwissens, um die Untersuchung von Kindern und Jugendlichen, die von HIV/TB betroffen sind, zu verbessern; eine langfristige Ausbildung anzubieten, die unabhängige swasiländische Forscherinnen und Forscher hervorbringt, die in den neuesten Fortschritten in den Bereichen Epidemiologie, Biostatistik und Bioinformatik, Verhaltenswissenschaft und Gesundheitsförderung sowie Gesundheitssystemmanagement und -politik geschult sind.
- Intensive Ausbildung im Lande im Bereich „Child Health Applied Research Training“ (CHART) für gut qualifizierte Siyakhula-Stipendiaten aus Partnereinrichtungen in Eswatini.
- Unterstützung der lokalen Forschungsinfrastruktur und der bestehenden Forschungsgemeinschaft bei gleichzeitiger Bereicherung des Umfelds und der Kapazitäten für die Bereitstellung von Forschungsmöglichkeiten für künftige Gesundheitsfachkräfte.
Siyakhula ist ein kombinierter binationaler Ansatz, der in erster Linie von Lernforen in Eswatini getragen wird, die durch strategische Lernmöglichkeiten in den USA ergänzt werden. Zwei zusätzliche Projekte erweitern die Stärke des Programms, indem sie Fachwissen über die Überschneidung von Klimawandel und öffentlicher Gesundheit sowie über die Auswirkungen der vorzeitigen Alterung durch HIV/TB und damit verbundene Komorbiditäten integrieren.
Zwei der drei Doktoranden (unabhängige Forscher) haben ihr zweijähriges Promotionsprogramm erfolgreich absolviert. Der dritte Doktorand wird sein Studium im August 2024 beginnen.
Siyakhula bildete 2022 die erste Gruppe von 15 CHART-Stipendiaten aus und fördert ihre Entwicklung und Ausbildung durch einzigartige, in eSwatini durchgeführte Lernaktivitäten, einschließlich der Unterstützung von acht Stipendiaten bei der Konzeption, Umsetzung und Analyse von unabhängig entwickelten Forschungsprojekten. Siyakhula bildet derzeit seine zweite Gruppe von 25 Stipendiaten aus.
Unter der Leitung von Dr. Anna Mandalakas, der Leiterin des Projekts, bietet eine feste Gruppe multinationaler Dozenten und Mentoren, darunter auch Partner vom Forschungszentrum Borstel, ein reichhaltiges Angebot an Vorlesungen.
Für weitere Informationen wenden Sie sich bitte an die Leiterin des Siyakhula-Programms, Dr. Debrah Vambe, unter debrah.vambe@bcm.edu.
 Das Konsortium Integrated Network of Scholars in Global Health Research Training (INSIGHT) umfasst vier akademische Einrichtungen in den USA (Baylor College of Medicine's Global TB Program, University of Alabama at Birmingham, University of Maryland Baltimore, University of Pittsburgh) und die ihnen verbundenen internationalen Einrichtungen in Afrika, Asien und Nord- und Südamerika. Das Programm wird vom Fogarty International Center (FIC) und mehreren kooperierenden Instituten und Zentren der U.S. National Institutes of Health (NIH) gefördert und ist eines der sieben Konsortien des NIH Fogarty Launching Future Leaders in Global Health (LAUNCH) Research Training Program. INSIGHT zielt darauf ab:
Das Konsortium Integrated Network of Scholars in Global Health Research Training (INSIGHT) umfasst vier akademische Einrichtungen in den USA (Baylor College of Medicine's Global TB Program, University of Alabama at Birmingham, University of Maryland Baltimore, University of Pittsburgh) und die ihnen verbundenen internationalen Einrichtungen in Afrika, Asien und Nord- und Südamerika. Das Programm wird vom Fogarty International Center (FIC) und mehreren kooperierenden Instituten und Zentren der U.S. National Institutes of Health (NIH) gefördert und ist eines der sieben Konsortien des NIH Fogarty Launching Future Leaders in Global Health (LAUNCH) Research Training Program. INSIGHT zielt darauf ab:
- Schaffung einer gemeinschaftlichen, multidisziplinären globalen Gesundheitsforschung, die eine institutionenübergreifende Zusammenarbeit von Mentoren vorsieht
- Bereitstellung eines einjährigen Mentorentrainings für 105 Stipendiaten
- Förderung und Unterstützung von Vielfalt, Gleichberechtigung und Integration in der wissenschaftlichen Ausbildung im Bereich der globalen Gesundheit
- Unterstützung des Übergangs der Stipendiaten in eine erfolgreiche und nachhaltige Forschungslaufbahn
Mit diesem Programm wird die betreute Forschungstätigkeit im Bereich der globalen Gesundheit für qualifizierte Doktoranden aus den USA und Postdoktoranden aus den USA und Ländern mit niedrigem und mittlerem Einkommen (Dr./PhD, ScD oder gleichwertiger Abschluss) gefördert. Erfolgreiche Bewerberinnen und Bewerber verbringen 12 Monate im Ausland an einer der 27 Partnereinrichtungen in 20 Ländern, wo sie Erfahrungen in der Forschung in einem internationalen Umfeld sammeln. Postdoktoranden aus Ländern mit niedrigem und mittlerem Einkommen erhalten eine Kurzzeitausbildung an der angegliederten Einrichtung in den USA. Die Forschungsprojekte der Trainees werden von erfahrenen und engagierten Mentorinnen und Mentoren unterstützt, die über Fachwissen in den Bereichen klinische Forschung, öffentliche Gesundheit, Labor und Anwendungsforschung verfügen.
Weitere Informationen über das INSIGHT-Schulungsprogramm finden Sie auf der INSIGHT-Website.
Tuberkulose (TB) ist die weltweit häufigste infektiöse Todesursache und verantwortlich für ein Drittel der Todesfälle bei Menschen, die mit HIV leben. Kinder und Jugendliche, die mit HIV leben, sind aufgrund unzureichender Präventionsmaßnahmen, großen Lücken bei der Erkennung von Erkrankungen, Problemen bei der Behandlung und der Akzeptanz der Behandlung sowie Wissenslücken unverhältnismäßig stark betroffen.
Das Projekt TB GAPS, das vom U.S. Center for Disease Control and Prevention (CDC) finanziert und vom Global TB Program des Baylor College of Medicine in Zusammenarbeit mit Partnern wie dem Forschungszentrum Borstel durchgeführt wird, liefert Erkenntnisse für Maßnahmen, die mehrere dieser Schwachstellen in der TB/HIV- Behandlungskette beseitigen sollen:
- Bewertung der Leistungsfähigkeit neuartiger Algorithmen für Tuberkulose-Screening und -Diagnose bei Kindern, Jugendlichen und Erwachsenen, die mit HIV leben und in einem Verbund von familienzentrierten HIV-Kliniken in fünf afrikanischen Ländern südlich der Sahara zur Routineversorgung vorgestellt werden. Es findet ein Vergleich zur derzeit von der WHO empfohlenen symptombasierten Screening- und Diagnosestrategie statt.
- Vergleich des Anteils von Menschen mit HIV, die eine präventive TB-Therapie (TPT) mit verschiedenen Therapieschemata einleiten und abschließen, im Rahmen eines patientenzentrierten, differenzierten Dienstleistungsmodells, das die Auswahl eines TPT-Regimes ermöglicht und nach dem Zufallsprinzip eine verstärkte Unterstützung der Therapietreue bietet, gegenüber der Standardversorgung für TPT und Unterstützung der Therapietreue.
- Bewertung der Kosteneffizienz erfolgreicher Tuberkulose-Screening- und -Diagnosestrategien und TPT-Schemata bei Kindern, Jugendlichen und Erwachsenen, die mit HIV leben.
- Verbreitung und Förderung der Übernahme von evidenzbasierten Best Practices in der TB-Prävention, -Erkennung und -Behandlung
Unter der Leitung von Dr. Mandalaks, der Projektleiterin, begann die TB-GAPS-Studie im Juli 2023 mit der Aufnahme von Patientinnen und Patienten in Eswatini, gefolgt von Lesotho im Oktober 2023, Malawi im Januar 2024 und Uganda im Februar 2024. Das Implementierungsteam beginnt derzeit mit der Aufnahme der Patientinnen und Patienten in Tansania. Die Studie wird voraussichtlich bis Anfang 2026 laufen. Weitere Informationen über TB GAPS finden Sie unter www.tbgaps.org.
DZIF (Deutsches Zentrum für Infektionsforschung)
- Individualisierung der Dauer der TB-Behandlung
- Identifizierung von Tuberkulose-Endotypen
- DZIF MD Projekte:
- Entwicklung einer Plattform zur Überwachung von Tuberkulose-Medikamenten
- Molekulare Vorhersage von Behandlungsschemata bei arzneimittelresistenter Tuberkulose
- Langfristige Behandlungserfolge bei Patienten mit multiresistenter Tuberkulose
- Die Auswirkungen der Migration im Zusammenhang mit dem Russland-Ukraine-Konflikt auf die Epidemiologie von Tuberkulose-Infektionen in der EU und im Europäischen Wirtschaftsraum
- Unmask-TB
- Nachweis von Mycobacterium tuberculosis aus Atemschutzmasken bei Erwachsenen mit Lungentuberkulose
EU-Projekte
- anTBiotic (EU-H2020)
- CLICK TB: Novel Clinical Candidates for TB (EDCTP)
- Stool4TB (EDCTP)
TBnet-Projekte
- Tuberkuloserisiko nach Organtransplantationen in Europa
- Internationales Konsensdokument zur molekularen Vorhersage der Arzneimittelresistenz
- Verwendung hepatoprotektiver Medikamente als unterstützende Therapie der Tuberkulose in Europa
- Tuberkulose bei im Ausland geborenen Personen in Europa
- Untersuchung des "QuantiFERON-TB-Gold-Plus"-Tests bei immundefizienten Individuen
- Management der XDR-Tuberkulose in Europa
Weitere Projekte
- Epidemiologie:
- Multiresistente Tuberkulose
- TB-Datenbank Medizinische Klinik Borstel
- Antibiotikaresistente-Tuberkulose: Analyse bei Migrantinnen und Migranten in der EU/EEA (in Kooperation mit ECDC)
- Prävention:
- Wirksamkeit der präventiven Antibiotika-Behandlung in Abhängigkeit vom Alter, der Tuberkuloseprävalenz und dem Mycobacterium tuberculosis-Infektionsstatus
- Diagnostik:
- Sputum MBLA als Monitoring Marker während der Therapie der Lungentuberkulose
- Stuhl-basierte PCR-Diagnostik der Lungentuberkulose
- Lipoarabinomannan (LAM) als potenzieller Marker zur Überwachung der Tuberkulosetherapie
- Lipoarabinomannan (LAM) als potenzieller Marker für die Diagnose von Tuberkulose aus Sputum
- Therapie:
- Klinische Standards für Antimicrobial Stewardship bei Tuberkulose
- Komplikationsrate bei selbst-applizierter Heim-Antibiotika-Therapie bei einer Infektion mit M. tuberculosis
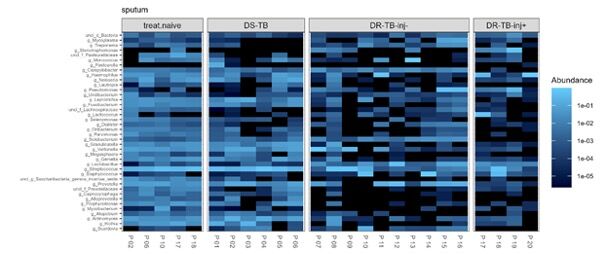
- Veränderung der Mikrobiota in Abhängigkeit von der Tuberkulosetherapie
- Auswirkungen von Bedaquilin auf das Behandlungsergebnis bei arzneimittelresistenter Tuberkulose
- Einsatz von TNF-Antagonisten und JAK-Inhibitoren bei Patient:innen mit früherer Tuberkulose
- Konsensempfehlungen für die Behandlung seltener nichttuberkulöser mykobakterieller Lungenkrankheiten
 Hintergrund:
Hintergrund:
Die Weltgesundheitsorganisation empfiehlt standardisierte Behandlungsdauern für Patienten mit Tuberkulose (TB). Wir haben eine Wirts-RNA-Signatur als Biomarker für individualisierte Therapiedauern bei Patienten mit arzneimittelsensibler (DS) und multiresistenter (MDR) TB identifiziert und validiert.
Methoden:
Erwachsene Patienten mit pulmonaler TB wurden prospektiv in fünf unabhängige Kohorten in Deutschland und Rumänien aufgenommen. Klinische und mikrobiologische Daten sowie Vollblut für die RNA-Transkriptomanalyse wurden zu festgelegten Zeitpunkten während der Therapie erhoben. Die Behandlungsergebnisse wurden anhand von TBnet-Kriterien (6-monatiger Kulturstatus/1 Jahr Nachbeobachtung) ermittelt. Ein Vollblut-RNA-Therapieendmodell wurde in einem mehrstufigen Prozess entwickelt, der einen Algorithmus des maschinellen Lernens einschloss, um hypothetische individuelle Behandlungsendzeitpunkte zu identifizieren.
Ergebnisse:
50 Patienten mit DS-TB und 30 Patienten mit MDR-TB wurden in den deutschen Identifikationskohorten (DS-GIC bzw. MDR-GIC) rekrutiert; 28 Patienten mit DS-TB und 32 Patienten mit MDR-TB in den deutschen Validierungskohorten (DS-GVC bzw. MDR-GVC); und 52 Patienten mit MDR-TB in der rumänischen Validierungskohorte (MDR-RVC). Aus den DS- und MDR-GIC-Daten wurde ein 22-Gene-RNA-Modell (TB22) abgeleitet, das die mit der Heilung verbundenen Zeitpunkte am Ende der Therapie definierte. Das TB22-Modell war anderen veröffentlichten Signaturen bei der genauen Vorhersage der klinischen Ergebnisse für Patienten in der DS-GVC überlegen (Fläche unter der Kurve 0,94, 95% CI 0,9-0. 98) und deutet darauf hin, dass eine Heilung bei TB-Patienten in der MDR-GIC (mittlere Verkürzung um 218,0 Tage, 34,2 %; p<0,001), der MDR-GVC (mittlere Verkürzung um 211,0 Tage, 32,9 %; p<0,001) und der MDR-RVC (mittlere Verkürzung um 161,0 Tage, 23,4 %; p=0,001) mit einer kürzeren Behandlungsdauer erreicht werden kann.
 Schlussfolgerung:
Schlussfolgerung:
Ein Biomarker-gesteuertes Management kann die Therapiedauer bei vielen Patienten mit MDR-TB erheblich verkürzen.
Registrierung der Studie: ClinicalTrials.gov NCT02597621.
 Hintergrund:
Hintergrund:
In-vitro-Untersuchungen, Tiermodelle und klinische Befunde deuten darauf hin, dass es sich bei der Tuberkulose nicht um eine monomorphe Krankheit handelt, sondern dass die Reaktion des Wirts auf die Tuberkulose unterschiedlich ist und mehrere verschiedene molekulare Wege und Pathologien (Endotypen) aufweist. Wir haben unvoreingenommenes Clustering angewandt, um separate Tuberkulose-Endotypen mit klassifizierbaren Genexpressionsmustern und klinischen Ergebnissen zu identifizieren.
Methoden:
Eine Kohorte mit Microarray-Genexpressionsdaten von mikrobiologisch bestätigten Tuberkulosepatienten wurde zur Identifizierung mutmaßlicher Endotypen verwendet. Eine Microarray-Kohorte mit longitudinalen klinischen Ergebnissen war für die Validierung reserviert, ebenso wie zwei RNA-Sequenzierungs-Kohorten. Schließlich wurde eine separate Kohorte von Tuberkulosepatienten mit funktioneller Immunität.
Ergebnisse:
In einer Entdeckungskohorte, die 435 Tuberkulosepatienten und 533 asymptomatische Kontrollpersonen umfasste, wurden zwei Tuberkulose-Endotypen identifiziert. Endotyp A zeichnet sich durch eine verstärkte Expression von Genen aus, die mit Entzündung und Immunität zusammenhängen, und durch eine verringerte Stoffwechsel- und Proliferationsaktivität; im Gegensatz dazu weist Endotyp B eine erhöhte Aktivität von Stoffwechsel- und Proliferationswegen auf. Eine unabhängige RNA-seq-Validierungskohorte, die 118 Tuberkulosepatienten und 179 Kontrollen umfasste, bestätigte die Entdeckungsergebnisse. Genexpressionssignaturen für Behandlungsversagen waren bei Endotyp A in der Entdeckungskohorte erhöht, und eine separate Validierungskohorte bestätigte, dass bei Patienten des Endotyps A die Zeit bis zur Kulturkonversion langsamer verging und die Heilungsrate geringer war. Diese Beobachtungen deuten darauf hin, dass die Endotypen die funktionelle Immunität widerspiegeln, was durch die Beobachtung gestützt wird, dass Tuberkulosepatienten mit einem hyperinflammatorischen Endotyp bei Stimulation eine weniger reaktionsfähige Zytokinproduktion aufweisen.
Schlussfolgerung:
Diese Ergebnisse belegen, dass die Erstellung von Stoffwechsel- und Immunprofilen zur Optimierung von Endotyp-spezifischen, wirtsspezifischen Therapien für Tuberkulose beitragen könnte.
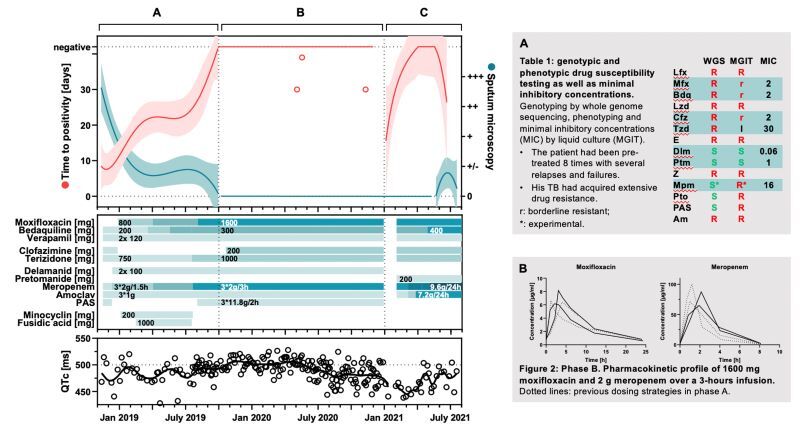 Entwicklung einer Plattform zur Überwachung von Tuberkulose-Medikamenten
Entwicklung einer Plattform zur Überwachung von Tuberkulose-Medikamenten
Die Behandlung der arzneimittelresistenten Mycobacterium tuberculosis beruht auf einer komplexen Antibiotikatherapie. Eine unzureichende Antibiotikaexposition kann zum Scheitern der Behandlung, zur erworbenen Arzneimittelresistenz und zu einem erhöhten Risiko für unerwünschte Ereignisse führen. Die therapeutische Arzneimittelüberwachung (TDM) kann zur Optimierung der Antibiotikaexposition eingesetzt werden. Daher haben wir uns zum Ziel gesetzt, einen Multiplex-Assay in einem einzigen Durchgang unter Verwendung der Hochleistungsflüssigkeitschromatographie-Massenspektrometrie (HPLC-MS) für das TDM von Patienten mit multiresistenter, präextensiv resistenter und extensiv resistenter Tuberkulose zu entwickeln. Auf der Grundlage der beabsichtigten klinischen Anwendung wurde ein Zielprofil für eine ausreichende Leistung festgelegt und der Assay entsprechend entwickelt. Die Antibiotika wurden auf einer zwitterionischen Flüssigchromatographiesäule mit hydrophiler Wechselwirkung und einem Triple-Quadrupol-Massenspektrometer unter Verwendung von mit stabilen Isotopen markierten internen Standards analysiert. Der Assay war ausreichend empfindlich, um die Arzneimittelkonzentrationen von Rifampicin, Rifabutin, Levofloxacin, Moxifloxacin, Bedaquilin, Linezolid, Clofazimin, Terizidon/Cycloserin, Ethambutol, Delamanid, Pyrazinamid, Meropenem, Prothionamid und Para-Aminosalicylsäure (PAS) über fünf Halbwertszeiten zu überwachen. Genauigkeit und Präzision waren ausreichend, um die klinische Entscheidungsfindung zu unterstützen (≤±15% in klinischen Proben und ±20-25% in aufgestockten Proben, wobei 80% der künftig gemessenen Konzentrationen innerhalb von ±40% der nominalen Konzentrationen liegen dürften). Die Methode wurde beim TDM von zwei Patienten mit komplexer arzneimittelresistenter Tuberkulose eingesetzt. Alle relevanten Antibiotika aus ihren Therapien konnten quantifiziert werden, und es wurde eine hochdosierte Therapie eingeleitet, gefolgt von einer mikrobiologischen Umstellung. Zusammenfassend lässt sich sagen, dass wir einen Multiplex-Assay entwickelt haben, der das TDM der relevanten Erst- und Zweitlinien-Antituberkulosemedikamente in einem einzigen Durchgang ermöglicht, und dass wir seine Anwendbarkeit beim TDM von zwei arzneimittelresistenten Tuberkulosepatienten nachweisen konnten.
doi: 10.3390/pharmaceutics15112543
Molekulare Vorhersage von Behandlungsschemata bei arzneimittelresistenter Tuberkulose
Hintergund:
Umfassende und zuverlässige Medikamentenempfindlichkeitstests (DST) sind dringend erforderlich, um Patienten mit multiresistenter/Rifampicin-resistenter Tuberkulose (MDR/RR-TB) angemessene Behandlungsschemata anbieten zu können. Wir haben untersucht, ob die Analyse von Isolaten des Mycobacterium tuberculosis-Komplexes und von Genen, die an der Arzneimittelresistenz beteiligt sind, durch Next-Generation Sequencing (NGS) die Entwicklung wirksamer MDR/RR-TB-Behandlungsschemata unterstützen kann.
Methoden:
NGS-basierte genomische DST-Vorhersagen von M. tuberculosis Komplex-Isolaten von MDR/RR-TB-Patienten, die zwischen dem 1. Januar 2015 und dem 30. April 2019 in ein TB-Referenzzentrum in Deutschland eingeliefert wurden, wurden mit phänotypischen DST-Ergebnissen von Mykobakterien-Wachstumsindikatorröhrchen (MGIT) verglichen. Standardisierte Behandlungsalgorithmen wurden angewandt, um individualisierte Therapien auf der Grundlage von genomischen oder phänotypischen DST-Ergebnissen zu entwerfen, und Diskrepanzen wurden durch die Bestimmung der minimalen hemmenden Arzneimittelkonzentrationen (MHK) mit Sensititre MYCOTBI- und UKMYC-Mikrotiterplatten weiter bewertet.
Ergebnisse:
Bei 70 Patienten mit MDR/RR-TB betrug die Übereinstimmung zwischen 1048 paarweisen Vergleichen von genomischem und phänotypischem DST 86,3 %; 76 (7,2 %) Ergebnisse waren nicht übereinstimmend, und 68 (6,5 %) konnten aufgrund des Vorhandenseins von Polymorphismen mit noch unbekannten Auswirkungen auf die Arzneimittelresistenz nicht ausgewertet werden. Wichtig ist, dass 549 von 561 (97,9 %) Vorhersagen zur Medikamentenempfindlichkeit in MGIT phänotypisch bestätigt wurden und 27 von 64 (42,2 %) falsch-positiven Ergebnissen mit zuvor beschriebenen Mutationen in Verbindung gebracht wurden, die eine niedrige oder moderate MHK-Erhöhung vermitteln. Praktisch alle Arzneimittel (99,0 %), die in Kombinationstherapien verwendet werden und die aus der genomischen DST abgeleitet wurden, wurden durch die phänotypische DST als empfindlich bestätigt.
Schlussfolgerungen:
Die NGS-basierte genomische DST kann eine zuverlässige Orientierungshilfe für das Design wirksamer MDR/RR-TB-Behandlungsschemata sein.
doi: 10.1093/cid/ciab359. PMID: 33900387
Langfristige Behandlungserfolge bei Patienten mit multiresistenter Tuberkulose
Zielsetzungen:
Beschreibung der langfristigen Behandlungsergebnisse bei Patientinnen undPatienten mit multiresistenter/Rifampicin resistenter Tuberkulose (MDR/RR-TB) und Validierung etablierter Ergebnisdefinitionen für die MDR/RR-TB-Behandlung.
Methoden:
Bei Patientinnen und Patienten mit MDR/RR-TB, die zwischen dem 1. September 2002 und dem 29. Februar 2020 in ein deutsches MDR/RR-TB-Überweisungszentrum eingewiesen wurden, verglichen wir die langfristigen Behandlungsergebnisse, die aus der individuellen Nachbeobachtung der Patienten abgeleitet wurden, mit den von der WHO-2013, der WHO-2021 und der Tuberculosis Network European Trials Group-2016 definierten Behandlungsergebnissen.
Ergebnisse:
Bei insgesamt 163 Patientinnen und Patienten (mittleres Alter, 35 Jahre; Standardabweichung, 13 Jahre; 14/163 [8,6 %] leben mit HIV; 109/163 [66,9 %] Männer, 149/163 [91,4 %] sind innerhalb von 5 Jahren nach Deutschland eingewandert) wurde die Behandlung einer kulturell bestätigten MDR/RR-TB eingeleitet. Eine zusätzliche Resistenz gegen ein Fluorchinolon oder ein injizierbares Mittel der zweiten Wahl lag bei 15 der 163 (9,2 %) Mycobacterium-tuberculosis-Stämme vor; eine Resistenz gegen beide Arzneimittelklassen war bei 29 der 163 (17,8 %) Stämme vorhanden. Die mediane Dauer der MDR/RR-TB-Behandlung betrug 20 Monate (Interquartilsbereich, 19,3-21,6 Monate), wobei ein Mittel aus fünf aktiven Medikamenten einbezogen wurde. Die mediane Nachbeobachtungszeit betrug 4 Jahre (47,7 Monate; Interquartilsbereich, 21,7 - 65,8 Monate). Unter den 163 Patienten wurde bei 25 (15,3 %), 82 (50,3 %) und 95 (58,3 %) Patienten eine Heilung gemäß den Ergebnisdefinitionen der WHO-2013, der WHO-2021 bzw. der Tuberculosis Network European Trials Group-2016 erreicht. Die Rate der verlorenen Nachbeobachtung betrug 17 von 163 (10,4 %). Der Tod war wahrscheinlicher bei Patientinnen und Patienten, die mit HIV leben (Hazard Ratio, 4,28; 95 % Konfidenzintervall, 1,26e12,86) und bei älteren Patientinnen und Patienten (Hazard Ratio, 1,08; 95 % Konfidenzintervall, 1,05e1,12; Inkrement von 1 Jahr). Insgesamt erlebten 101/163 (62,0 %) Patientinnen und Patienten eine langfristige, rückfallfreie Heilung; davon waren 101/122 (82,8 %) Patienten mit bekanntem Status (nicht „lost to follow-up“ oder verlegt) bei der Nachuntersuchung.
Schlussfolgerung:
Bei optimaler Behandlung und unter Einsatz individualisierter Therapieschemata ist die langfristige, rückfallfreie Heilung von MDR/RR-TB wesentlich höher als die Heilungsraten nach den derzeitigen Definitionen der Behandlungsergebnisse.
doi: 10.1093/cid/ciab359. PMID: 33900387
Die Auswirkungen der Migration im Zusammenhang mit dem Russland-Ukraine-Konflikt auf die Epidemiologie von Tuberkulose-Infektionen in der Europäischen Union und im Europäischen Wirtschaftsraum
Die Tuberkulose-Melderate in der Ukraine ist etwa sechsfach höher als die Gesamt-Melderate in der Europäischen Union (EU) und dem Europäischen Wirtschaftsraum (EWR). Außerdem ist die Ukraine ein Hochprioritätsland für die Weltgesundheitsorganisation in Bezug auf Antibiotika-resistente Tuberkulose. Nach Angaben von Eurostat sind seit Beginn des Krieges zwischen Russland und der Ukraine etwa 5 Millionen Ukrainer in die Länder der EU und des EWRs vertrieben worden.
In enger Zusammenarbeit mit dem Europäischen Zentrum für die Prävention und die Kontrolle von Krankheiten (European Center for Disease Prevention and Control, ECDC) haben wir die Tuberkulose-Epidemiologie bei in der EU/im EWR gemeldeten Fälle ukrainischer Herkunft von 2019 bis 2022 anhand von routinemäßig erhobenen Daten bewertet.
Unsere Ergebnisse zeigten, dass sich die Zahl der gemeldeten Tuberkulosefälle bei Ukrainern in der Region im Jahr 2022 fast vervierfacht hat (n = 780, gegenüber durchschnittlich n = 201 in den drei Vorjahren). Die Fälle ukrainischer Herkunft machten jedoch weiterhin nur einen geringen Anteil (2,2 % in 2022) aller in der EU/im EWR gemeldeten Fälle aus. Außerdem lagen die Melderaten bei ukrainischen Staatsbürgern in der EU/im EWR unter den in der Ukraine gemeldeten Werten und blieben unter 20 pro 100,000. Der Anteil der Antibiotika-resistenten Tuberkuloseformen an den Fällen ukrainischer Herkunft in der EU/im EWR war hoch und spiegelt die hohe Proportion an resistenten Fälle in der Ukraine wider. Im Jahr 2022 war fast jeder fünfte antibiotika-resistente TB-Fall in der EU/im EWR ukrainischer Herkunft.
Diese Ergebnisse unterstreichen die Wichtigkeit der migrantensensiblen und patientenzentrierten Gesundheitsversorgung, um eine frühzeitige Vorstellung, Einleitung und Fortsetzung der Behandlung sicherzustellen. Aufgrund der hohen Rate an Antibiotika-resistenten Fälle sind Erreger-Nachweis und Empfindlichkeitstestung bei TB-Patient:innen aus der Ukraine von entscheidender Bedeutung.
doi: 10.2807/1560-7917.ES.2024.29.12.2400094
Unmask-TB
Ziel des Forschungsprojektes Unmask-TB war es, modifizierte FFP2 Masken als diagnostischen Test für eine Lungentuberkulose bei Kindern zu entwickeln und zu erproben. Noch heute kann eine Tuberkuloseerkrankung bei Kindern oft nur klinisch diagnostiziert werden, das heißt es fehlt der sichere Nachweis von tuberkulösen Mykobakterien in einem Labortest. Bei Kindern ist das Nicht-Erkennen einer Tuberkulose sehr gefährlich; unerkannt und daher unbehandelt versterben bis zu 40% der Kinder unter fünf Jahren an einer Tuberkulose.
Zungenabstriche, Stuhl, Urin und diese modifizierten Masken könnten vielversprechende neue Probentypen sein: Die Gewinnung dieser Proben ist weniger belastend für Kinder im Vergleich zu herkömmlichen Methoden, wie der Ansaugung von Magensaft. Auch deuten erste Studien darauf hin, dass manche dieser neuen Methoden eine Tuberkulose bei Kindern besser erkennen können. Am Forschungszentrum Borstel haben wir deshalb, bei Erwachsenen erfolgreich getestete, FFP2-Masken für Kinder angepasst. Diese enthalten einen 3D-gedruckten Polyvinylalkohol-Streifen, der Bakterien-DNA in der Ausatemluft auffangen soll. Unsere Methode ist Teil der großen „TB GAPS“ Studie des Baylor College of Medicine, Houston, USA, in mehreren Ländern des südlichen Afrikas. Das Deutsches Zentrum für Infektionsforschung hat uns bei der aufwendigen Entwicklung der Methode immer wieder umfänglich unterstützt.
Die für Kinder angepassten FFP2-Masken hatten in vitro eine niedrige Nachweisgrenze für M. tuberculosis-spezifische DNA. Allerdings konnte in keiner der 30 Masken, die von Kindern mit Lungentuberkulose getragen wurden, M. tuberculosis-DNA nachgewiesen werden. In dieser Form modifizierte FFP2-Masken können M. tuberculosis bei Kindern möglicherweise nicht effektiver nachweisen als bestehende Methoden.
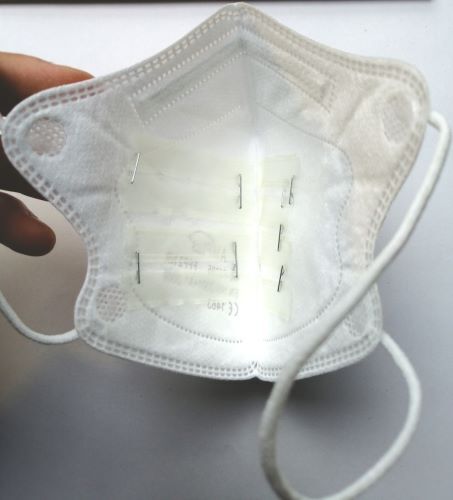

Nachweis von Mycobacterium tuberculosis aus Atemschutzmasken bei Erwachsenen mit Lungentuberkulose
Ziel der Studie war es, den Nachweis von Mycobacterium tuberculosis bei Erwachsenen zu vereinfachen und gegebenenfalls eine Methode zu etablieren, welche den Prozess weniger invasiv und kosteneffizienter gestaltet.
Mit einer Sensitivität von 86,5% in der Originalstudie (Williams et al. 2020) schien es vielversprechend, Face Mask sampling (FMS) weiter zu untersuchen. In der ursprünglichen Studie wurden FFP2-Masken mit zusätzlichen Gelatinefiltern zum Nachweis von MTB verwendet, in der Folge auch Polyvinylalkohol (PVA)-Streifen. Um kostengünstig und vergleichbar arbeiten zu können, wurden im Forschungszentrum Borstel eigens PVA-Streifen entwickelt und produziert, die auch in Zukunft kostengünstig vor Ort hergestellt werden können.
Mit einer Inzidenz von 80 Neuinfektionen/100.000 Einwohner, davon ein Drittel MDR-TB, steht die Republik Moldau vor einer großen Herausforderung und bietet eine spannende Möglichkeit, unsere seit Jahren bestehende Kooperation fortzusetzen.
In Moldawien untersuchen wir in Zusammenarbeit mit der Lungenklinik „Chiril Draganiuc“ und dem Nationalen Referenzlabor für Mykobakterien in Moldawien die Wirksamkeit von FMS bei Erwachsenen.
Zwischen April 2024 und Februar 2025 wurden insgesamt 117 Erwachsene in die Studie aufgenommen. 103 von ihnen (88,0 %) wiesen ein positives Ergebnis in der Sputumkultur und/oder im Xpert MTB/RIF Ultra-Test auf. Von den Teilnehmern, die in diesem kombinierten Referenzstandard positiv getestet wurden, waren 59,2 % (61/103) auch im FMS-Test positiv. Im Vergleich zur Sputumkultur und zum Sputum-Xpert MTB/RIF Ultra-Test betrug die Sensitivität des FMS-Tests 64,4 % (95 %-KI: 54,4 %–74,4 %) bzw. 58,3 % (95 %-KI: 48,1 %–68,0 %). Von den 90 Teilnehmern mit positiver Sputumkultur waren 6,0 % (5/90) im FMS-Test negativ. Diese Ergebnisse unterstreichen das Potenzial für einen zusätzlichen Nutzen und die komplementäre Rolle des FMS-Tests. Wo die Ressourcen es zulassen, kann FMS als wertvolles Diagnoseinstrument dienen, das parallel zu herkömmlichen Diagnoseverfahren eingesetzt wird, um die schnelle Erkennung von Lungentuberkulose bei Erwachsenen zu verbessern.



Neue Tuberkulose-Therapien werden benötigt, um die Arzneimittelresistenz, die lange Behandlungsdauer und die unerwünschten Wirkungen der verfügbaren Mittel zu bekämpfen. GSK3036656 (Ganfeborol) ist das erste Benzoxaborol seiner Klasse, das die Leucyl-tRNA-Synthetase von Mycobacterium tuberculosis hemmt. In dieser randomisierten, offenen Phase-2a-Studie wurden die frühe bakterientötende Wirkung (primäres Ziel) sowie die Sicherheit und Pharmakokinetik (sekundäre Ziele) von Ganfeborol bei Teilnehmern mit unbehandelter, Rifampicin-empfänglicher Lungentuberkulose untersucht. Insgesamt wurden 75 Männer 14 Tage lang einmal täglich mit Ganfeborol (1/5/15/30 mg) oder der Standardbehandlung (Rifafour e-275 oder generische Alternative) behandelt. Bei den Teilnehmern, die einmal täglich 5, 15 und 30 mg Ganfeborol erhielten, wurde eine numerische Verringerung der täglichen koloniebildenden Einheiten im Sputum gegenüber dem Ausgangswert beobachtet, nicht jedoch bei den Teilnehmern, die 1 mg Ganfeborol erhielten. Die Raten unerwünschter Ereignisse waren in allen Gruppen vergleichbar; alle Ereignisse waren Grad 1 oder 2. Bei einer Untergruppe von Teilnehmern zeigte eine explorative computergestützte Post-hoc-Analyse der 18F-Fluordesoxyglucose-Positronenemissionstomographie/Computertomographie-Befunde eine messbare Reaktion auf die Behandlung bei mehreren Läsionstypen bei denjenigen, die Ganfeborol 30 mg an Tag 14 erhielten. Die Analyse der transkriptionellen Behandlungsreaktion im Vollblut auf Ganfeborol 30 mg am Tag 14 zeigte eine starke Assoziation mit neutrophil-dominierten Transkriptionsmodulen. Die nachgewiesene bakterizide Wirkung und das akzeptable Sicherheitsprofil lassen darauf schließen, dass Ganfeborol ein potenzieller Kandidat für die Kombinationsbehandlung von Lungentuberkulose ist.
Im Rahmen des vom EDCTP geförderten Projekts „CLICK TB“ wurden neue Therapieschemata zur Behandlung von Tuberkulose (TB), insbesondere von arzneimittelresistenter TB (MDR-TB), untersucht. Ziel war die klinische Prüfung neuer Wirkstoffkombinationen mit neuen Wirkstoffen, die das Potenzial haben, die TB-Therapie effizienter, verträglicher und sicherer zu gestalten. Dem internationalen Konsortium gehören Wissenschaftler aus Spanien und England (GSK), Südafrika (TASK, UCT), Norwegen (Universität Tromsø) und Borstel an.
- Sanfetrinem-Cilexetil ist ein sicheres orales Carbapenem mit intrinsischer Stabilität gegenüber TB-β-Laktamasen. Der Wirkstoff wurde bereits erfolgreich in einer Phase-II-Studie als Breitspektrum-Antibiotikum klinisch getestet. Dies war Voraussetzung für die Prüfung von Sanfetrinem in einer Phase-IIa-Studie zur „frühen bakteriziden Aktivität“ hinsichtlich seiner bakteriziden Wirkung bei TB.
- GSK3036656 ist der erste Wirkstoff einer neuen Klasse, der selektiv die mykobakterielle LeuRS hemmt, ein Enzym, das für die Proteinsynthese von Mykobakterien von zentraler Bedeutung ist. Die Phase-I-Studie mit diesem Wirkstoff wurde erfolgreich abgeschlossen.
- DprE1-Inhibitoren: Drei neuartige, nicht-kovalente Inhibitoren, die an der Zellwandsynthese beteiligt sind, befinden sich in der präklinischen Entwicklungsphase.
Die klinischen Studien wurden in einem erfahrenen Studienzentrum in Südafrika (TASK) durchgeführt. Blut-, Plasma-, Serum- und Urinproben wurden gesammelt und im Labor für klinische Infektionsforschung auf Transkriptomsignaturen und transrenale mykobakterielle DNA analysiert. Eine umfassende Biomarkeranalyse (PET/CT und biologische Marker) ist im Gange, um neue Alternativen zu herkömmlichen kulturbasierten Methoden zur Bestimmung der bakteriziden Aktivität einzelner Wirkstoffe oder Wirkstoffkombinationen zu identifizieren. Es wurde ein statistisches Modell entwickelt, um die Ergebnisse verschiedener Kombinationen zu vergleichen und den relativen Beitrag jeder Wirkstoffkomponente zu bestimmen.
Das vom EDCTP finanzierte Projekt „Stool4TB“ evaluierte eine innovative, stuhl-basierte qPCR-Diagnostikplattform. Ziel war es, die extrem große Lücke bei der Erkennung von Tuberkulose (TB) zu schließen, indem die TB-Bestätigungsraten bei Kindern und HIV-Infizierten verbessert werden. Tuberkulose zählt weiterhin zu den häufigsten Ursachen für weitere Erkrankungen und Todesfälle in diesen Gruppen. Die labordiagnostische Bestätigung von Tuberkulose ist in diesen Gruppen besonders schwierig, da es nur schwer möglich ist, Sputumproben zu erhalten und die Proben nur wenige Mycobakterien enthalten.
Das Projekt wurde in Eswatini, Mosambik und Uganda durchgeführt. Zwischen diesen drei Ländern, die alle eine hohe Tuberkulose-Inzidenz aufweisen, wurde ein Tuberkulose-Diagnostiknetzwerk aufgebaut. Dieses wird auch zukünftig in der Lage sein, klinische Studien für neue Diagnoseverfahren und Medikamente mit Fokus auf Kinder und HIV-Infizierte durchzuführen.
Als einer der Projektpartner beteiligte sich das Forschungszentrum Borstel aktiv am Aufbau einer Biobank mit Proben für zukünftige Tuberkuloseforschung. Blutproben wurden in PAXgene- und QuantiFERON-TB Gold (QFT)-Röhrchen entnommen, um die TB22-Signatur und das Konzept der Endotypen bei Tuberkulose im Kindesalter zu validieren. RNA-Sequenzierungs- und QFT-Daten der Studienproben dienen dazu, das Potenzial von TB22 für die Tuberkulosediagnostik bei Kindern zu bestätigen und seine Eignung als Marker zur Prognose des Krankheitsverlaufs bei Kindern nachzuweisen. Darüber hinaus soll gezeigt werden, dass TB22 als Marker für die individualisierte Therapiedauer bei Kindern dienen kann. Es werden multidimensionale Analysen in RNAseq- und QFT-Daten durchgeführt, um Endotypen bei Kindern weiter zu definieren.
Weitere Informationen zum Projekt finden Sie unter: https://www.stool4tb.org/
Diese europäische Multicenter-Studie zeigt, dass Empfänger:innen solider Organtransplantate (SOT) auch in Ländern mit niedriger bis mittlerer Tuberkuloseinzidenz ein deutlich erhöhtes Risiko für Tuberkulose (TB) haben. Untersucht wurden über 5.800 erwachsene Transplantatempfänger:innen aus 15 Zentren in acht europäischen Ländern durch Forschende der Tuberculosis Network European Trials Group (TBnet).
Insgesamt traten 23 bestätigte TB-Fälle auf, was einer Inzidenz von 68 Fällen pro 100.000 Personenjahre entspricht – etwa sechsmal höher als in der Allgemeinbevölkerung. Besonders hoch war das Risiko in Südeuropa mit 252 Fällen pro 100.000 Personenjahre, etwa neunmal höher als in Zentraleuropa. Auch Patient:innen mit Migrationsgeschichte hatten ein deutlich erhöhtes Erkrankungsrisiko.
Die Studie zeigt, dass nur ein Drittel der Transplantierten vor der Transplantation auf latente TB untersucht wurde und nur jede zehnte Person eine präventive Therapie erhielt. Die meisten TB-Fälle traten erst mehr als zwei Jahre nach der Transplantation auf, was auf eine Kombination aus Reaktivierung latenter Infektionen und Neuinfektionen hindeutet.
Die Autoren betonen die Bedeutung eines regional angepassten Präventionsansatzes: Gezieltes Screening in Niedriginzidenzregionen und universelles Screening mit präventiver Therapie in Hochinzidenzregionen könnten das TB-Risiko bei immungeschwächten Transplantatpatient:innen deutlich senken.
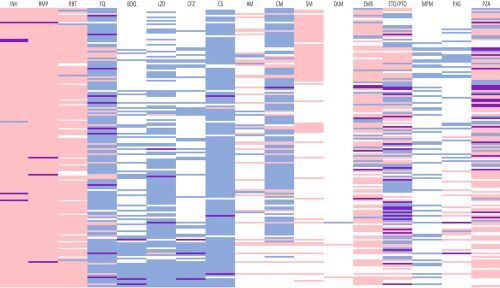
Die arzneimittelresistente Tuberkulose stellt weltweit ein großes Problem für das Gesundheitswesen dar. Obwohl kulturbasierte Methoden als Goldstandard für die Prüfung der Medikamentenempfindlichkeit gelten, liefern molekulare Methoden schnelle Informationen über die Mutationen von Mycobacterium tuberculosis, die mit der Resistenz gegen Anti-Tuberkulose-Medikamente einhergehen. Dieses Konsenspapier wurde auf der Grundlage einer umfassenden Literaturrecherche des TBnet- und des RESIST-TB-Netzes über Berichtsstandards für den klinischen Einsatz molekularer Arzneimittel-Empfindlichkeitstests erstellt. Die Überprüfung und die Suche nach Belegen umfasste die manuelle Durchsicht von Zeitschriften und die Suche in elektronischen Datenbanken. Das Gremium identifizierte Studien, die Mutationen in genomischen Regionen von M. tuberculosis mit Daten über Behandlungsergebnisse in Verbindung brachten. Die Durchführung molekularer Tests zur Vorhersage der Arzneimittelresistenz von M. tuberculosis ist von entscheidender Bedeutung. Der Nachweis von Mutationen in klinischen Isolaten hat Auswirkungen auf die klinische Behandlung von Patienten mit multiresistenter oder Rifampicin-resistenter Tuberkulose, insbesondere in Situationen, in denen phänotypische Empfindlichkeitstests nicht verfügbar sind. Ein multidisziplinäres Team, dem Kliniker, Mikrobiologen und Laborwissenschaftler angehörten, erzielte einen Konsens zu den wichtigsten Fragen, die für die molekulare Vorhersage der Medikamentenempfindlichkeit oder -resistenz von M. tuberculosis relevant sind, sowie zu deren Auswirkungen auf die klinische Praxis.
Anekdotische Informationen deuten darauf hin, dass die klinische Praxis hinsichtlich des Einsatzes vermeintlich hepatoprotektiver Wirkstoffe bei der Tuberkulosebehandlung in den Ländern der Europäischen Region der WHO unterschiedlich ist. Zwischen November 2023 und Mai 2024 führten wir unter Vertretern der Tuberculosis Network European Trials Group (TBnet) in den Ländern der Europäischen Region der WHO eine standardisierte Fragebogenerhebung zum Einsatz vermeintlich hepatoprotektiver Wirkstoffe bei der Behandlung von Tuberkulosepatient:innen durch.
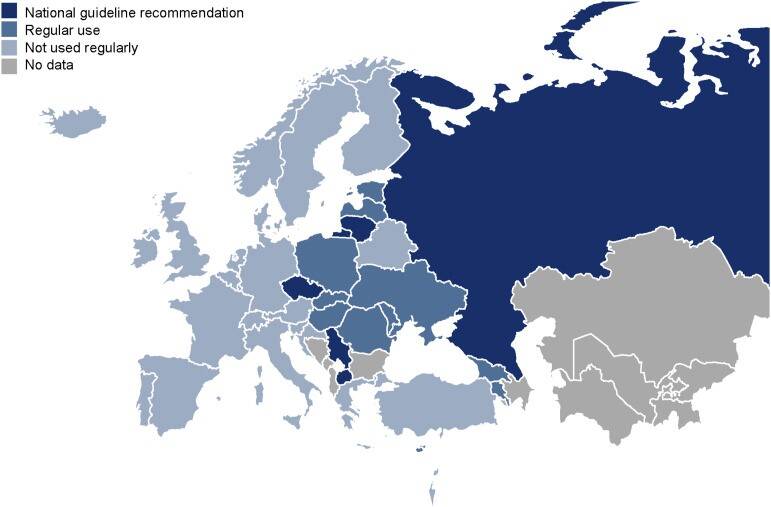
Wir erhielten gültige Antworten aus 37 von 53 Ländern (69,8%), von denen 16 (43,2%) den regelmäßigen Einsatz vermeintlich hepatoprotektiver Wirkstoffe während der TB-Behandlung meldeten. Die Hälfte dieser Länder (n = 8) ist Teil der ehemaligen Sowjetunion. In fünf Ländern werden diese Mittel in nationalen Leitlinien empfohlen. Die am häufigsten verwendeten vermeintlich hepatoprotektiven Wirkstoffe waren Silibin/Silymarin (n = 9, 56,3%), Ursodeoxycholsäure (n = 5, 31,3%) und Sojaphospholipide (n = 4, 25,0%). Die Behandlungsdauer variierte: 56,3 % (n = 9) nahmen sie weniger als 1 Monat lang ein, 18,8 % (n = 3) 1-3 Monate lang und 18,8 % (n = 3) 4-6 Monate lang. Mutmaßlich hepatoprotektive Wirkstoffe werden in der Europäischen Region der WHO in großem Umfang als Ergänzung zur Tuberkulosebehandlung eingesetzt, insbesondere in den Ländern der ehemaligen Sowjetunion, von denen einige sie in ihre nationalen Leitlinien aufgenommen haben.
Hintergrund:
Europäische Strategien zur Eliminierung der Tuberkulose (TB) erfordern die Identifizierung von Schlüsselgruppen, die von einem TB-Screening profitieren.
Ziel:
Wir wollten Gruppen von im Ausland geborenen Personen mit Wohnsitz in europäischen Ländern identifizieren, die am meisten von einem gezielten TB-Präventionsscreening profitieren.
Methoden:
Die europäische Studiengruppe des Tuberkulose-Netzwerks erhob in einer Querschnittserhebung die Zahl der im Ausland geborenen Tuberkulosepatienten mit Wohnsitz in den Ländern der Europäischen Union (EU), Island, Norwegen, der Schweiz und dem Vereinigten Königreich (UK) im Jahr 2020 aus den zehn Herkunftsländern mit der höchsten Zahl an Tuberkulosefällen in jedem Wohnsitzland. Die Tuberkulose-Inzidenzraten (IRs) in den Wohnsitzländern wurden mit denen der Herkunftsländer verglichen.
Ergebnisse:
Es wurden Daten über 9.116 im Ausland geborene TB-Patienten in 30 Wohnsitzländern gesammelt. Hauptherkunftsländer waren Eritrea, Indien, Pakistan, Marokko, Rumänien und Somalia. Die Tuberkulose-IRs waren am höchsten bei Patienten eritreischer und somalischer Herkunft in Griechenland und Malta (beide > 1.000/100.000) und am niedrigsten bei ukrainischen Patienten in Polen (3,6/100.000). Sie waren vor allem in den Wohnsitzländern niedriger als in den Herkunftsländern. Allerdings waren die IRs unter Eritreern und Somaliern in Griechenland und Malta fünfmal höher als in Eritrea und Somalia. Ebenso waren die IR unter Eritreern in Deutschland, den Niederlanden und dem Vereinigten Königreich viermal so hoch wie in Eritrea.
Schlussfolgerungen:
Die Tuberkulose-Infektionsrate des Herkunftslandes ist ein unzureichender Indikator, wenn es darum geht, im Ausland geborene Bevölkerungsgruppen für die aktive Fallfindung oder die Tuberkulose-Prävention in den hier untersuchten Ländern anzusprechen. Eliminierungsstrategien sollten sich auf regelmäßig erhobene länderspezifische Daten stützen, um der sich rasch verändernden Epidemiologie und den damit verbundenen Risiken Rechnung zu tragen.
In weiten Teilen Europas spielt Tuberkulose keine große Rolle mehr, obwohl manche den Erreger noch in sich tragen. Für Menschenmit geschwächtem Immunsystem, zum Beispiel nach einer Organtransplantation oder bei einer HIV-Infektion, kann die bakterielle Infektion jedoch nach wie vor sehr gefährlich sein. Als diagnostischer Standardtest wird häufig der so genannte „QuantiFERON-TB-Gold-Plus“-Test (QFT+) eingesetzt. Der QFT+ ist ein indirekter Test, d.h. er weist nicht den Erreger selbst nach, sondern die Reaktion des Immunsystems auf di esen. Ist das Immunsystem geschwächt, sei es gezielt, um die Abstoßung eines Spenderorgans zu verhindern, oder durch einen das Immunsystem schwächenden Erreger wie HIV, fällt auch die Immunantwort auf den Tuberkulose-Erreger schwächer aus. Der QFT+-Test kann dann also häufiger falsch negativ ausfallen.
esen. Ist das Immunsystem geschwächt, sei es gezielt, um die Abstoßung eines Spenderorgans zu verhindern, oder durch einen das Immunsystem schwächenden Erreger wie HIV, fällt auch die Immunantwort auf den Tuberkulose-Erreger schwächer aus. Der QFT+-Test kann dann also häufiger falsch negativ ausfallen.
Um die Aussagekraft des QFT+-Test zum Nachweis einer Infektion mit Mykobakterien und einer Tuberkuloseerkrankung zu untersuchen, wurden von 2015 bis 2019 in einer groß angelegten multizentrischen Studie des TBnet über 2600 Patienten untersucht. Zudem wurde durch eine Nachbeobachtung über zwei Jahre verfolgt, wie gut der Test zur Beurteilung des Risikos, eine Tuberkulose zu entwickeln, geeignet ist. 1788 Menschen stammten dabei aus einer von fünf Gruppen, deren Immunsystem geschwächt war: Menschen mit Organtransplantation, mit Stammzelltransplantation, mit rheumatoider Arthritis, chronischer Niereninsuffizienz oder einer HIV-Infektion. 861 weitere, immungesunde Personen dienten als Kontrollgruppe. Die Patienten wurden an 21 medizinischen Zentren in elf europäischen Ländernbehandelt.
Als Ergebnis der Studie zeigte sich, daß der QFT+-Test nicht aussagekräftig genug ist, um ihn für die Diagnose der aktiven Erkrankung alleine einzusetzen. Die Anforderungen der WHO an einen Tuberkulosetest werden nicht erfüllt. 
Zudem ist die Vorhersagekraft des Tests für eine zukünftige Erkrankung sehr gering. Auch nach zwei Jahren gab es weder bei den positiv noch bei den negativ getesteten Personen eine aktive Tuberkulose-Erkrankung – selbst dann nicht, wenn der QFT+-Test positivwar und keine vorbeugende Therapie erfolgte. Lediglich einige HIV-positive Personen entwickelten in Einzelfällen aktive Tuberkulose. Der QFT+-Test reicht also nicht aus, um das individuelle Risiko einer Tuberkulose in Niedriginzidenz-Ländern zuverlässig vorherzusagen. Deshalb sollten künftig zusätzliche Risikofaktoren – wie HIV-Status, Immunlage undHerkunft – stärker in die Entscheidung über eine präventive Behandlung einfließen.
Im Jahr 2021 hat die Weltgesundheitsorganization die Definitionen für die „extensiv-resistente“ Tuberkulose (XDR-TB) geändert. Bei dieser Form der Erkrankungen weisen die Tuberkulosebakterien ein besonders hohes Niveau der Antibiotikaresistenz auf. Neben dem Schlüsselmedikament Rifampicin liegen auch Resistenzen gegenüber Fluorochinolonen und Bedaquilin und/oder Linezolid vor. Noch ist diese Form der Tuberkulose in Europa sehr selten.
In einer beobachtenden retrospektiven Kohortenstudie wurden an vielen Behandlungszentren in der WHO-Region Europa Daten von Patienten gesammelt, bei denen im Zeitraum von 2017 bis 2023 eine XDR-TB diagnostiziert wurde.Von 11.003 Patienten mit Rifampicin-resistenter Tuberkulose hatten 188 Patienten (1,7 %) aus 16 Ländern eine XDR-TB. Nur vier von zehn Patienten mit XDR-TB konnten erfolgreich behandelt werden, einer von zehn verstarb an der Erkrankung. Dies sind wesentlich schlechtere Therapie-Ergebnisse als bei weniger resistenten Tuberkulosebakterien. Die Resultate der Studie unterstreichen die Notwendigkeit adäquater, individualisierter Therapieschemata und optimierter Resistenztestung.
 Multiresistente Tuberkulose
Multiresistente Tuberkulose
Tuberkulose (TB) ist weltweit nach wie vor die häufigste Todesursache durch eine Infektionskrankheit. Multiresistente oder Rifampicin-resistente Tuberkulose (MDR/RR-TB; Resistenz gegen Rifampicin und Isoniazid oder nur gegen Rifampicin) ist in mehreren Teilen der Welt, insbesondere in Osteuropa, Russland, Asien und Afrika südlich der Sahara, eine wachsende Herausforderung für die öffentliche Gesundheit. Präextensiv arzneimittelresistente TB (pre-XDR-TB) bezieht sich auf MDR/RR-TB, die auch gegen ein Fluorchinolon resistent ist, und extensiv arzneimittelresistente TB-Isolate (XDR-TB) sind zusätzlich gegen andere wichtige Medikamente wie Bedaquilin und/oder Linezolid resistent. Zusammen werden diese Untergruppen als arzneimittelresistente TB (DR-TB) bezeichnet. Alle Formen der DR-TB können genauso übertragbar sein wie die Rifampicin-empfängliche TB, sind jedoch schwieriger zu diagnostizieren und gehen mit einer höheren Mortalität und Morbidität sowie einer höheren Rate an Lungenschäden nach der Tuberkulose einher. Die verschiedenen Formen der DR-TB verschlingen oft mehr als 50 % der nationalen Tuberkulosebudgets, obwohl sie nur 5-10 % der gesamten Tuberkulosefälle ausmachen. In den letzten zehn Jahren hat sich die DR-TB-Behandlungslandschaft mit der Einführung neuer Diagnostika und Therapeutika dramatisch verändert. Es gibt jedoch nur wenige Anleitungen für das Verständnis und den Umgang mit verschiedenen Aspekten dieser komplexen Erkrankung, einschließlich der Pathogenese, Übertragung, Diagnose, Behandlung und Prävention von MDR-TB und XDR-TB, insbesondere auf der Ebene der Hausärzte.
doi: 10.1038/s41572-024-00504-2
TB-Datenbank Medizinische Klinik Borstel
In den 10 Jahren von 2012 bis 2021 haben wir über 800 Tuberkulosepatientinnen und -patienten stationär behandelt, davon ca. 150 Erkrankte mit einer multiresistenten Tuberkulose (MDR-TB) und ca. 30 Erkrankte mit einer extensiv-resistenten Tuberkulose (XDR-TB). In unserer Klinik wurden routinemäßig Daten erhoben, die für die richtige Diagnose und erfolgreiche Behandlung einzelner Patienten notwendig sind. Alle Patientendaten wurden nach den gesetzlichen Vorschriften der Datenschutzverordnung dokumentiert. Daten aus dem Klinischen Labor, der Molekularbiologie oder der Mikrobiologie wurden in engen Zeitabständen erfasst, um Veränderungen in der Menge und in der Antibiotikaempfindlichkeit der Tuberkulosebakterien zu charakterisierenden und um den Verlauf der Tuberkuloseerkrankung und das Ansprechen der Therapie zu dokumentieren. Dadurch konnten wir auf Veränderungen ggf. rasch reagieren. Zudem wurden Informationen über die Therapie (Medikamente, Dosierung, ggf. Operationen), eventuelle Nebenwirkungen und den Heilungserfolg der Therapie erfasst. Damit versuchen wir u.a. Risikofaktoren für verzögertes Ansprechen der Behandlungen oder Therapieversagen zu identifizieren.
Diese im klinischen Alltag anfallenden Daten wurden in einer Datenbank zusammengeführt, sodaß die Datenerhebungen für klinische Studien stark vereinfacht und zusätzliche wissenschaftliche Auswertungen möglich wurden. So sind mit Hilfe der Datenbank Fallstudien über einzelne Borsteler Patienten entstanden, z.B. zu MDR-Silikotuberkulose bei einem Steinbruch-Arbeiter und zu einem Patienten mit extrem resistenter XDR-Tuberkulose. Bei einer Zwischenauswertung der Datenbank konnte gezeigt werden, daß bei aktiven und ehemaligen Rauchern deutlich länger Tuberkulosebakterien überlebten als bei Nichtrauchern.
Die Daten der Datenbank wurden in verschiedenen abgeschlossenen und noch laufenden Studien verwendet, z.B.
- Langzeit-Behandlungsergebnisse bei MDR-Tuberkulose
- MDR-Tuberkulose-Behandlung basierend auf DNA-Sequenzierung
- Port-Infektionen bei intravenöser ambulanter Therapie
- Vorhersage von Linezolid-Nebenwirkungen
- im Projekt DZIF Biomarkerforschung
- im Projekt DZIF Therapeutic Drug Monitoring
- im Exzellenzcluster Precision Medicine: Individualisierte Therapie von chronischen Lungeninfektionen
- in der TBnet-Studie Management of XDR-TB in Europe
- in einem weltweiten systematischen Review zu Behandlungsergebnissen bei Kindern und Jugendlichen mit MDR-Tuberkulose (BENEFIT Kids)
Antibiotikaresistente-Tuberkulose: Analyse bei Migrantinnen und Migranten in der EU/EAA (in Partnerschaft mit ECDC)
Tuberkulosefälle mit Antibiotikaresistenz stellen weiterhin ein bedeutendes epidemiologisches Problem dar. Weltweit verursachten Rifampicin- und multiresistente (RR/MDR) Tuberkulosefälle im Jahr 2022 schätzungsweise 160.000 Todesfälle. In Ländern und Regionen mit niedriger Tuberkuloseinzidenz sind im Ausland geborene Personen häufiger von antibiotikaresistenter Tuberkulose betroffen.
Im Jahr 2023 stiegen die Tuberkulose-Meldungen bei Menschen mit Migrationshintergrund in der Europäischen Union und dem Europäischen Wirtschaftsraum (EU/EWR) um 24,6 %, nachdem sie zwischen 2019 und 2020 zurückgegangen waren. Die meisten Betroffenen stammten aus Afrika und dem östlichen Mittelmeerraum, wobei die Tuberkulosefälle unter Ukrainern in den Jahren 2022/23 um 316,4 % zunahmen. Die Ukraine gehört zu den europäischen Ländern mit der höchsten Tuberkulose-Inzidenz und ist weltweit eines der Länder mit der höchsten Belastung durch antibiotikaresistente Tuberkulose. Zudem stand das ukrainische Gesundheitssystem in jüngster Zeit vor zwei beispiellosen Herausforderungen: der COVID-19-Pandemie und dem Ausbruch eines bewaffneten Konflikts. Bis Dezember 2023 erhielten rund 5 Millionen vertriebene Ukrainer vorübergehenden Schutzstatus in EU-/EWR-Ländern. Infolge dieses erheblichen Bevölkerungswachstums hat sich die Gesamtzahl der gemeldeten Tuberkulosefälle unter Ukrainern in der Region im Jahr 2022 nahezu vervierfacht. Rifampicinresistente/multiresistente Tuberkulose nahm im Zeitraum 2019–2023 um mindestens 60 % zu, hauptsächlich unter Ukrainern.
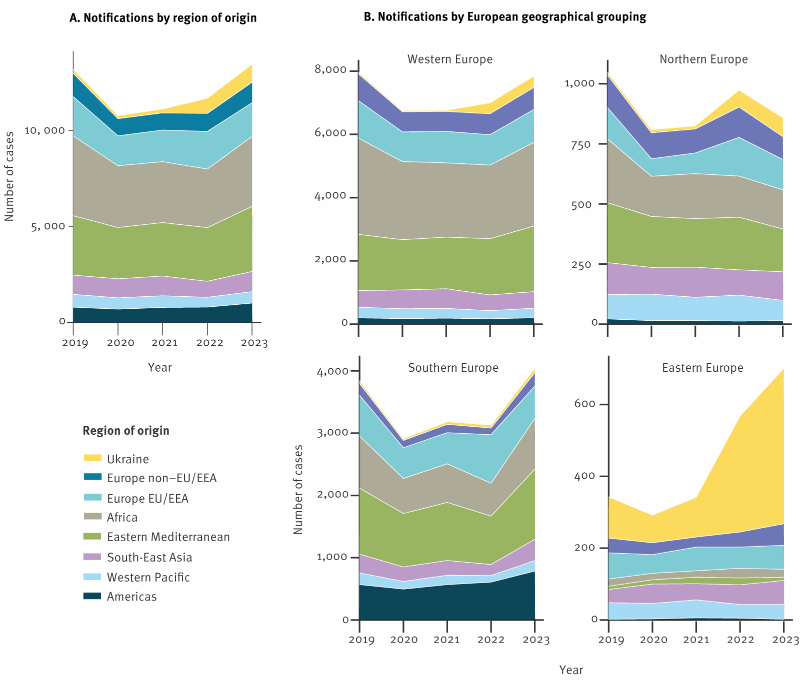
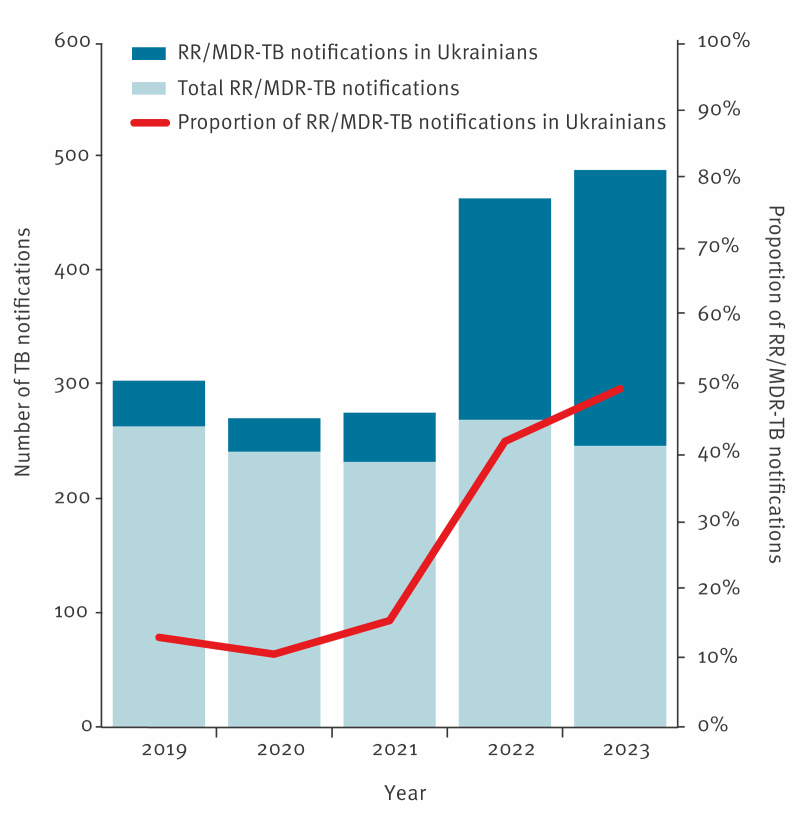
Eine rasche Anpassung an die sich verändernden epidemiologischen Muster, die zunehmende Verfügbarkeit von Daten zur Arzneimittelempfindlichkeit, eine verbesserte Überwachung von Arzneimittelresistenzen, eine bessere Nachverfolgung mobiler Bevölkerungsgruppen und eine Stärkung der Maßnahmen im Bereich der öffentlichen Gesundheit sind entscheidend für die Eindämmung der Tuberkuloseausbreitung in der EU/im EWR.
Wirksamkeit der präventiven Antibiotika-Behandlung in Abhängigkeit vom Alter, der Tuberkuloseprävalenz und dem Mycobacterium tuberculosis-Infektionsstatus
Tuberkulose ist eine vermeidbare Krankheit. Es ist jedoch umstritten, welche Personen am meisten von einer präventiven Tuberkulosebehandlung profitieren würden und ob dieser Nutzen in Settings mit hoher und niedriger Tuberkulosebelastung unterschiedlich ist. Unser Ziel war es, die Wirksamkeit der präventiven Tuberkulosebehandlung bei exponierten Personen unterschiedlichen Alters und Mycobacterium tuberculosis-Infektionsstatus unter Berücksichtigung der Tuberkulosebelastung der der Einstellungen.
In dieser systematischen Übersichtsarbeit und Meta-Analyse mit Einzelteilnehmern untersuchten wir die Entwicklung von Tuberkulose bei Personen, die eng mit tuberkulosekranken Personen zusammenleben. Wir suchten in MEDLINE, Web of Science, BIOSIS und Embase nach Studien, die zwischen dem 1. Januar 1998 und dem 6. April 2018 veröffentlicht wurden. Wir beschränkten unsere Suche auf Kohortenstudien; Fall-Kontroll-Studien und Ausbruchsberichte wurden ausgeschlossen. Zwei Reviewer bewerteten Titel, Abstracts und Volltextartikel auf ihre Eignung. In jeder Phase erörterten zwei Gutachter Unstimmigkeiten und bewerteten die Artikel erneut, bis ein Konsens erzielt wurde. Von den Autoren aller in Frage kommenden Studien wurden Daten zu den einzelnen Teilnehmern und eine vorab festgelegte Liste von Variablen angefordert, einschließlich der Merkmale des exponierten Kontakts, des Indexpatienten und der Umweltmerkmale; Kontakte, die einem arzneimittelresistenten Tuberkulose-Indexpatienten ausgesetzt waren, wurden ausgeschlossen. Das primäre Studienergebnis war das Auftreten von Tuberkulose. Wir schätzten die bereinigten Hazard Ratios (aHRs) für das Auftreten von Tuberkulose mit Cox-Regressionsmodellen mit gemischten Effekten und einem Zufallseffekt auf Studienebene. Wir schätzten die Anzahl der erforderlichen Behandlungen (NNT), um die Entwicklung einer Tuberkulose bei einer Person zu verhindern. In allen Analysen wurden Propensity-Score-Matching-Verfahren verwendet. Diese Studie ist bei PROSPERO registriert (CRD42018087022).
Nach einem Screening von 25 358 Datensätzen wurden 439 644 Teilnehmer aus 32 Kohortenstudien in die Meta-Analyse der individuellen Teilnehmerdaten einbezogen. Die Teilnehmer wurden über einen Zeitraum von 1 396 413 Personenjahren (Median von 2-7 Jahren [IQR 1-3-4,4]) beobachtet, in denen bei 2496 Personen eine neue Tuberkulose diagnostiziert wurde. Insgesamt lag die Wirksamkeit der präventiven Behandlung bei 49 % (aHR 0-51 [95% CI 0-44-0-60]). Teilnehmer mit einem positiven Ergebnis des Tuberkulin-Hauttests (TST) oder des IFNγ-Freisetzungstests (IGRA) bei Studienbeginn profitierten von einem größeren Schutz, unabhängig vom Alter (0-09 [0-05-0-17] bei Kindern unter 5 Jahren, 0-20 [0-15-0-28] bei Personen im Alter von 5-17 Jahren und 0-17 [0-13-0-22] bei Erwachsenen ab 18 Jahren). Die Wirksamkeit der präventiven Behandlung war bei hoher Prävalenz (0-31 [0-23-0-40]) größer als bei niedriger Prävalenz (0-58 [0-47-0-72]). Die NNT reichte von 9 bis 34 je nach Alter unter den Teilnehmern mit einem positiven TST oder IGRA sowohl bei hoher als auch bei niedriger Prävalenz; unter allen Kontakten (unabhängig vom TST- oder IGRA-Testergebnis) reichte die NNT von 29 bis 43 bei hoher Prävalenz und 213 bis 455 bei niedriger Prävalenz.
Unsere Ergebnisse deuten darauf hin, dass eine risikoorientierte Strategie, die sich vorrangig an Kontaktpersonen mit Anzeichen einer M tuberculosis-Infektion richtet, in Umgebungen mit geringer Tuberkulose Prävalenz angezeigt sein könnte, während in Umgebungen mit hoher Tuberkulose Prävalenz ein breiter Ansatz, der alle Kontaktpersonen einbezieht, in Betracht gezogen werden sollte. Die Präventivbehandlung war bei Kontaktpersonen aller Altersgruppen ähnlich wirksam.


Sputum MBLA als Monitoring Marker während der Therapie der Lungentuberkulose
Nach Diagnose einer Tuberkulose wird die antituberkulöse Therapie eingeleitet und der Behandlungsverlauf in den nächsten mindestens sechs Monaten regelmäßig überwacht, um möglichst frühzeitig ein Therapieversagen zu erkennen. Wichtigster Nachweis eines Therapieansprechens ist die Kulturnegativierung, d. h. das Ausbleiben des Wachstums der Mykobakterien in der mikrobiologischen Kultur über acht Wochen. Eine molekularbiologische Methode zum schnelleren Nachweis von Mykobakterium tuberculosis im Sputum ist dabei die Vervielfältigung genomischer mykobakterieller DNA (z. B. GeneXpert®). Dieses Testsystem kann aber nicht zwischen toten und lebensfähigen TB-Bakterien unterscheiden, so dass ein positiver Befund nicht sicher ein Therapieversagen vorhersagen kann. Die Bestimmung der Expression replizierender Gene im neuen Testsystem des Molekularen Tuberkulose-Bakterienbelastungstest (MBLA) hat den Vorteil, dass nur lebensfähige Bakterien detektiert werden.
In dieser prospektiven Beobachtungs-Kohortenstudie wurde in Zusammenarbeit mit Marit Neumann und Prof. Dr. Christoph Hölscher (Infektionsimmunologie) erstmals die Genauigkeit des TB-MBLA bei der Bewertung der Bakterienlast evaluiert, um das Therapieansprechen bei Erwachsenen mit pulmonaler MDR/XDR-Tuberkulose überwachen zu können. Die Ergebnisse des TB-MBLA wurden mit der Mikroskopie, der GeneXpert-Methode und der Zeit bis zur Kulturpositivität (TTP) in der Mycobacterial Growth Indicator Tube (MGIT) Kultur verglichen.
MBLA war Mikroskopie und GeneXpert überlegen bei der frühzeitigen Identifizierung einer erfolgreichen Kulturkonversion und könnte ein nützlicher Biomarker zur Bewertung neuer Substanzen in Phase-II-Studien zur frühen bakteriziden Aktivität von Arzneimitteln sein, unabhängig vom Grad der Arzneimittelresistenz von M.tuberculosis.
doi: 10.1016/j.jinf.2024.106399
Stuhl-basierte PCR-Diagnostik der Lungentuberkulose
Hintergrund:
Trotz der zunehmenden Verfügbarkeit von molekularen Schnelltests für die Diagnose von Tuberkulose in Gebieten mit hoher Tuberkulosebelastung werden viele Menschenmit Tuberkulose nicht diagnostiziert. Die Abhängigkeit von Sputum als Hauptprobe für die Tuberkulosediagnostik trägt zu dieser diagnostischen Lücke bei. Wir haben die diagnostische Genauigkeit und den Zusatznutzen eines neuartigen quantitativen PCR-Tests (qPCR) für die Diagnose von Tuberkulose in drei afrikanischen Ländern mit hoher Tuberkulosebelastung untersucht.
Methoden:
Wir haben in Eswatini, Mosambik und Tansania vom 21. September 2020 bis zum 2. Februar 2023 eine prospektive Studie zur diagnostischen Genauigkeit durchgeführt, um die diagnostische Genauigkeit eines neuartigen qPCR-Tests für Tuberkulose mit dem derzeitigen diagnostischen Standard für den Nachweis von Mycobacterium-tuberculosis-DNA aus Sputum und Stuhl, Xpert-MTB/RIF Ultra (Xpert Ultra), zu vergleichen. Sputum-, Stuhl- und Urinproben wurden von einer Kohorte von Teilnehmern im Alter von 10 Jahren oder älter zur Verfügung gestellt, bei denen Tuberkulose diagnostiziert worden war. Teilnehmer mit Tuberkulose (Fälle) wurden innerhalb von 72 Stunden nach Beginn der Behandlung einer klinisch diagnostizierten oder im Labor bestätigten Tuberkulose aufgenommen. Die Teilnehmer ohne Tuberkulose (Kontrollen) bestanden aus Haushaltskontakten der Fälle, die während einer 6-monatigen Nachbeobachtungszeit keine Tuberkulose entwickelten. Die Leistung wurde mit einem robusten zusammengesetzten mikrobiologischen Referenzstandard (CMRS) verglichen.
Ergebnisse:
Die Kohorte von Jugendlichen und Erwachsenen (n=408) umfasste 268 Teilnehmer mit bestätigter oder klinischer Tuberkulose (Fälle), von denen 147 (55%) mit HIV lebten, und 140 Teilnehmer (Kontrollen) ohne Tuberkulose. Die Sensitivität der neuartigen Stuhl-qPCR betrug 93-7 % (95 % CI 87-4-97-4) im Vergleich zu Teilnehmern mit nachweisbarem Wachstum auf einer M-Tuberkulose-Kultur und 88-1 % (81-3-93-0) im Vergleich zu Sputum Xpert Ultra. Die qPCR des Stuhls hatte eine gleichwertige Empfindlichkeit wie Sputum Xpert Ultra (94-8%, 89-1-98-1) im Vergleich zur Kultur. Im Vergleich zum CMRS war die Sensitivität der Stuhl-qPCR höher als der derzeitige Standard für die Tuberkulose-Diagnostik auf Stuhl, Xpert Ultra (80-4%, 73-4-86-2 vs. 73-5%, 66-0-80-1; p=0-025 im paarweisen Vergleich). Die qPCR identifizierte auch 17-21 % zusätzliche Tuberkulosefälle im Vergleich zu Sputum Xpert Ultra oder Sputumkultur. Bei Kontrollen ohne Tuberkulose lag die Spezifität der qPCR im Stuhl bei 96-9 % (92-2-99-1).
Interpretation:
In dieser Studie wies eine neuartige qPCR für die Diagnose von Tuberkulose aus Stuhlproben bei Jugendlichen und Erwachsenen eine höhere Genauigkeit auf als der derzeitige diagnostische PCR-Goldstandard für Stuhl, Xpert-MTB/RIF Ultra, und eine gleichwertige Sensitivität wie Xpert-MTB/RIF Ultra für Sputum.
Finanzierung:
National Institutes of Health (NIH) Allergy and Infectious Diseases, und NIH Fogarty International Center.
doi: 10.1016/S2666-5247(23)00391-9
Lipoarabinomannan (LAM) als potenzieller Marker zur Überwachung der Tuberkulosetherapie
Lipoarabinomannan (LAM), ein Glykolipid der Mykobakterien-Zellwand, spielt eine wesentliche Rolle in der Pathogenese der Tuberkulose (TB). LAM ist in Körperflüssigkeiten wie Urin nachweisbar, so dass es sich als diagnostischer Biomarker eignet, insbesondere bei HIV-positiven Patienten.
Der aktuelle Goldstandard der TB-Diagnostik ist der kulturelle Nachweis von Mycobacterium tuberculosis in Sputumproben. Allerdings können einige Patienten kein oder nicht ausreichend Sputum produzieren(z.B. Kinder, ältere Menschen, immungeschwächte Personen). Verschiedene Testsysteme zielen darauf ab, LAM in klinischen Proben nachzuweisen, um eine schnelle und nicht-invasive Diagnosestellung zu ermöglichen.
In dieser retrospektiven Kohortenstudie wurde der ultrasensitive elektrochemilumineszente LAM Test (EclLAM) von Meso Scale Discovery, Inc. evaluiert, um LAM im Urin von HIV-sero-negativen Patienten mit pulmonaler TB zu messen, sowohl zur Diagnose aktiver TB als auch zur Überwachung der TB-Behandlung. Es wurden zu verschiedenen Zeitpunkten (vor und nach Beginn der Therapie) gewonnene Proben von mikrobiologisch bestätigten TB-Patienten aus Südafrika und Deutschland analysiert.
Beide verwendete Antikörperpaare, FDX-01/FIND-28 und S4-20/A194-01, identifizierten korrekt Patienten mit aktiver TB. Darüber hinaus korrelierten beide Antikörperpaare mit der Zeit bis zur positiven Kultur und waren somit für die Therapieüberwachung geeignet. Insgesamt unterstreichen diese Ergebnisse das Potenzial von LAM als Biomarker sowohl für die Diagnose als auch für die Therapieüberwachung. Weitere Forschung sollte die Entwicklung von nicht-invasiven, empfindlichen, spezifischen und quantitativen LAM-Tests priorisieren.
doi: 10.1016/S2213-2600(24)00083-3
Lipoarabinomannan (LAM) als potenzieller Marker für die Diagnose von Tuberkulose aus Sputum
Tuberkulose (TB) bleibt trotz moderner Therapien eine der weltweit führenden Infektionskrankheiten. Ein zentrales Ziel der Diagnostik ist es, Infektionen möglichst frühzeitig und zuverlässig nachzuweisen. Lipoarabinomannan (LAM), ein Bestandteil der Mykobakterien-Zellwand, ist während einer aktiven Infektion in verschiedenen Körperflüssigkeiten nachweisbar.
Der PATHFAST™ TB LAM Ag Test (PATHFAST LAM, PHC Corporation, Tokio, Japan) ist ein automatisierter In-vitro-Diagnostiktest zur Quantifizierung von LAM. Im Rahmen dieses Forschungsprojekts wurden Sputumproben von 27 Personen mit pulmonaler Tuberkulose und von 20 Kontrollpersonen untersucht. Dabei wurden die diagnostische Genauigkeit des Tests, die Korrelation zwischen der LAM-Konzentration und der bakteriellen Last sowie die Reproduzierbarkeit der Testergebnisse analysiert.
Die LAM-Konzentrationen waren in den Sputumproben von Personen mit TB höher (Median: 241,5 pg/mL) im Vergleich zu der LAM-Konzentration bei Personen ohne TB (0 pg/mL), mit einer Sensitivität von 85,2 % und einer Spezifität von 100 %. Die LAM-Konzentration korrelierte sowohl mit den Mikroskopie- und Abstrichbefunden (rho = 0,86) als auch mit der Zeit bis zur Positivität in der MGIT-Kultur (rho = −0,65). Durch eine Homogenisierung der Proben konnte die Reproduzierbarkeit der Testergebnisse verbessert werden (Variationskoeffizient 4,5 % vs. 72,6 %).
Der PATHFAST LAM erfüllt die WHO Target Product Profile Kriterien zur Tuberkulosediagnostik aus Sputum. Die LAM-Konzentration korreliert mit der bakteriellen Last und die Reproduzierbarkeit der Testergebnisse profitiert von einer Homogenisierung der Proben.


Klinische Standards für Antimicrobial Stewardship bei Tuberkulose
Das Projekt zur Entwicklung der „Clinical Standards for Antimicrobial Stewardship in Tuberculosis" hatte das Ziel, klare und evidenzbasierte Empfehlungen für den verantwortungsvollen Einsatz antituberkulöser Medikamente zu erarbeiten. Während Antimicrobial Stewardship (AMS) in der Infektiologie generell zunehmend an Bedeutung gewinnt, blieb es im Bereich der Tuberkulose bislang unzureichend definiert – ein bedeutendes Defizit, insbesondere vor dem Hintergrund, dass Rifampicin-resistente TB (RR-TB) von der WHO als eine der vier kritischsten bakteriellen Bedrohungen eingestuft wurde. Um diese Lücke zu schließen, hat ein internationales Expertengremium mit rund 60 Spezialist:innen im Rahmen eines strukturierten Delphi-Prozesses fundierte Empfehlungen für AMS in der TB-Behandlung entwickelt. Ziel der klinischen Standards ist es, den rationalen Einsatz antituberkulöser Medikamente zu optimieren, um die Behandlungsqualität zu verbessern, das Risiko resistenter TB-Stämme zu minimieren und langfristig zur weltweiten TB-Kontrolle beizutragen. Durch die interdisziplinäre Zusammenarbeit von führenden Expert:innen aus den Bereichen TB-Diagnostik, Therapie und AMS aus allen Regionen der Welt wurde sichergestellt, dass die entwickelten Standards wissenschaftlich fundiert, praxisnah und auf die Bedürfnisse von Gesundheitssystemen weltweit zugeschnitten sind. Dieses Projekt stellt einen wichtigen Schritt dar, um AMS als integralen Bestandteil der TB-Behandlung zu etablieren und die globale Strategie gegen resistente TB-Erreger nachhaltig zu stärken.
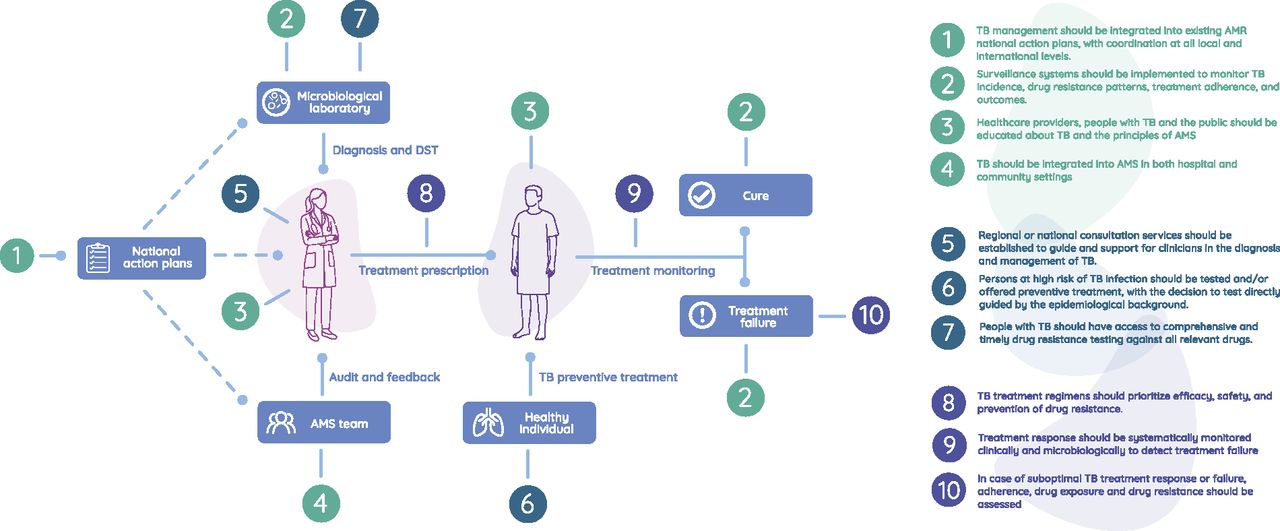
doi: 10.5588/ijtldopen.25.0522
Komplikationsrate bei selbst-applizierter Heim-Antibiotika-Therapie bei einer Infektion mit M. tuberculosis
Die Behandlung von Tuberkulose wird aufgrund zunehmender Antibiotikaresistenzen immer schwieriger. Bei einigen Patienten mit multiresistenter (MDR) oder extensiv resistenter (XDR) Tuberkulose müssen injizierbare Antibiotika (Meropenem und/oder Amikacin) eingesetzt werden. Da die Therapie mehrere Monate dauert, muss die intravenöse Therapie ambulant fortgesetzt werden. Ein Port wird gelegt, und der Patient wird in der selbstständigen Verabreichung der Medikamente geschult.
Die Studie begleitete 89 Patienten mit multiresistenter (MDR) und präextensiv resistenter (prä-XDR) TB über einen Zeitraum von sechs Jahren. Die am meisten gefürchteten Komplikationen der intravenösen Heimtherapie sind Infektionen oder Thrombosen des Dauerkatheters. Sie können zu einer Sepsis führen und eine chirurgische Entfernung des Katheters erforderlich machen. Im Untersuchungszeitraum erlitten jedoch nur acht Patienten diese schweren Komplikationen, wobei die Gesamtkomplikationsrate lediglich 0,3 pro 1.000 Behandlungstage betrug. Keine dieser Komplikationen verlief tödlich. Der häufigste Grund für einen Behandlungsabbruch waren unerwünschte Arzneimittelwirkungen (13,5 %), weniger Komplikationen durch die intravenösen Portsysteme.
Mit der richtigen Schulung und Infrastruktur ermöglicht die Selbstmedikation über einen Port den Patienten eine sichere Behandlung. Dies reduziert die Notwendigkeit längerer Krankenhausaufenthalte und gewährleistet gleichzeitig einen hohen Pflegestandard.
doi: 10.1007/s40265-024-02122-4
Veränderung der Mikrobiota in Abhängigkeit von der Tuberkulosetherapie
Die Behandlung von Patientinnen und Patienten mit arzneimittelresistenter Tuberkulose ist durch die Anzahl und Art der Antibiotika und die lange Dauer der Therapie geprägt, die die Vielfalt und Zusammensetzung der menschlichen Mikrobiota beeinflussen. Die Zweitlinien-Anti-TB-Behandlung umfasst mehrere Breitbandantibiotika, insbesondere die injizierbaren Aminoglykoside und Carbapeneme.
In dieser Studie wurde in Zusammenarbeit mit Dr. Mathias Hauptmann aus der Forschungsgruppe Zelluläre Mikrobiologie untersucht, wie sich verschiedene Zweitlinien-Anti-TB-Behandlungsschemata bei Patientinnen und Patienten mit unterschiedlichem Grad an arzneimittelresistenter TB auf die Vielfalt der menschlichen Mikrobiota in Lunge und Darm auswirken.
Dabei zeigte eine Standard-Anti-TB-Therapie von Personen mit sensibler Tuberkulose nur wenig Veränderungen im Mikrobiom aus Darm und Atemwegen innerhalb der ersten 4 – 6 Wochen nach Therapiebeginn. Wenn in der Behandlung bei medikamentenresistenter Tuberkulose intravenös zu verabreichende Antibiotika aus der Gruppe der Aminoglykoside und / oder Carbapeneme gegeben werden mussten, führte dies nach 6 Wochen zu einer Abnahme der Vielfalt des Darmmikrobioms. Unter dieser Therapie nahm ebenfalls die relative Vielfalt der Pathobionten in den Atemwegen ab, so dass ein erhöhtes Risiko für eine Verschlechterung der Tuberkulose und eine Sepsis entstehen könnten.
doi: 10.5588/ijtldopen.24.0325
Auswirkungen von Bedaquilin auf das Behandlungsergebnis bei arzneimittelresistenter Tuberkulose
Hintergrund:
Die Bewertung neuartiger Tuberkulosemedikamente zur Behandlung von multiresistenter Tuberkulose (MDR-TB) steht weiterhin auf der Agenda der Tuberkuloseforschung. Wir untersuchten die Behandlungsergebnisse bei Patienten mit pulmonaler MDR-TB, die in der Republik Moldau, einem Land mit hoher MDR-TB-Belastung, eine Bedaquilin-haltige Behandlung erhielten.
Methoden:
Wir analysierten systematisch die nationale elektronische TB-Datenbank SIMETB und führten einen retrospektiven Propensity-Score-Vergleich der Behandlungsergebnisse in einer Kohorte von Patienten mit MDR-TB durch, die zwischen 2016 und 2018 eine Behandlung mit einem Bedaquilin-haltigen Regime (Bedaquilin-Kohorte) begonnen hatten, und einer Kohorte von Patienten, die ohne Bedaquilin behandelt wurden (Nicht-Bedaquilin-Kohorte).
Ergebnisse:
Nach einem Propensity-Score-Matching wurden jeder Kohorte von MDR-TB-Patienten 114 Patienten zugewiesen. Die Patienten in der Bedaquilin-Kohorte hatten eine höhere 6-Monats-Konversionsrate bei Sputumkulturen als die Patienten in der Nicht-Bedaquilin-Kohorte (66,7 % gegenüber 40,3 %; p<0,001). Patienten, die Bedaquilin-haltige Therapien erhielten, hatten eine höhere Heilungsrate sowohl nach der Definition der Weltgesundheitsorganisation (WHO) als auch nach der TBnet-Definition (55,3 % gegenüber 24,6 %; p=0,001 bzw. 43,5 % gegenüber 19,6 %; p=0,004) sowie eine niedrigere Sterblichkeitsrate (8,8 % gegenüber 20,2 %; p<0,001 bzw. 10,9 % gegenüber 25,2 %; p=0,01). Bei Patienten, bei denen zuvor eine MDR-TB-Behandlung versagt hatte, erreichten mehr als 40 % eine Heilung mit einem Bedaquilin-haltigen Regime.
Schlussfolgerungen:
Bedaquilin-haltige MDR-TB-Behandlungsschemata führen im Vergleich zu MDR-TB-Behandlungsschemata ohne Bedaquilin unter programmatischen Bedingungen in einem Land mit einer hohen MDR-TB-Prävalenz zu einem besseren Therapieergebnis.
doi: 10.1183/13993003.02544-2020
Einsatz von TNF-Antagonisten und JAK-Inhibitoren bei Patient:innen mit früherer Tuberkulose
Tumor-Nekrose-Faktor (TNF)-Antagonisten und Januskinase (JAK)-Inhibitoren sind entscheidende Behandlungsoptionen bei chronisch-entzündlichen Erkrankungen wie der rheumatoiden Arthritis. Es ist aktuell unklar, wie Erkrante, die in der Vergangenheit eine Tuberkulose hatten, aber aufgrund anderer Erkrankungen auf TNF-Antagonisten oder JAK-Inhibitoren angewiesen sind, behandelt werden sollen. Im Rahmen eines systematischen Reviews haben wir die medizinische Literatur nach entsprechenden Fallberichten durchsucht und 368 Erkrankte identifiziert, die während oder nach einer Tuberkulose mit TNF-Antagonisten behandelt wurden. Lediglich 14 dieser Patientinnen und Patienten (3,8 %) entwickelten erneut eine Tuberkulose. Unter den elf Betroffenen, die während oder nach einer Tuberkulose einen JAK-Inhibitor erhielten, entwickelte lediglich ein Patient (9,1 %) erneut eine Tuberkulose. Diese niedrigen Zahlen legen nahe, dass der Einsatz von TNF-Antagonisten und JAK-Inhibitoren bei Patientinnen und Patienten mit aktueller oder durchgemachter Tuberkulose im Rahmen einer individuellen Risiko-Nutzen-Abwägung gerechtfertigt sein kann.
doi: 10.1016/j.cmi.2024.04.011
Konsensempfehlungen für die Behandlung seltener nichttuberkulöser mykobakterieller Lungenkrankheiten
Die internationale Leitlinie von 2020 für die Behandlung nicht-tuberkulöser mykobakterieller Lungenerkrankungen (NTM-PD) der American Thoracic Society, der European Respiratory Society, der European Society of Clinical Microbiology and Infectious Diseases und der Infectious Diseases Society of America sowie die Managementleitlinie 2017 der British Thoracic Society befassten sich mit Lungenerkrankungen bei Erwachsenen, die durch Mycobacterium avium complex, Mycobacterium kansasii, Mycobacterium xenopi und Mycobacterium abscessus verursacht werden. Um evidenzbasierte Empfehlungen für die Behandlung von weniger häufigen nicht-tuberkulösen Mykobakterien (NTM) bei erwachsenen Patienten ohne Mukoviszidose oder HIV-Infektion zu geben, führte unsere Expertengruppe eine systematische Literaturrecherche durch, um Leitlinien für die Behandlung von Lungenerkrankungen zu erstellen, die durch sieben weitere Organismen verursacht werden: Mycobacterium chelonae, Mycobacterium fortuitum, Mycobacterium genavense, Mycobacterium gordonae, Mycobacterium malmoense, Mycobacterium simiae, und Mycobacterium szulgai. Die Behandlungsempfehlungen wurden im Rahmen eines strukturierten Konsensverfahrens erarbeitet. Die Evidenz aus der in englischer Sprache veröffentlichten wissenschaftlichen Literatur für Behandlungsempfehlungen bei Lungenerkrankungen, die durch andere NTM-Spezies verursacht werden, war mit Ausnahme von M malmoense von sehr geringer Qualität und basierte auf der Auswertung von Fallberichten und Fallserien. Für M. malmoense lieferten die Ergebnisse von zwei randomisierten kontrollierten Studien und drei retrospektiven Kohortenstudien eine bessere Evidenzbasis für Behandlungsempfehlungen, obwohl die Evidenz immer noch von geringer Qualität war.
DZIF – Deutsches Zentrum für Infektionsforschung
- DZIF Klinisches Tuberkulose-Zentrum (Clin TB)
- Förderer: DZIF
- Projektverantwortlicher in der Forschungsgruppe: Prof. C. Lange
- Projektpartner: DZIF
- Laufzeit: 2026-2030
- Deutsche TB-Kohorte / TB-Proben Bio-Repository
- Förderer: DZIF
- Projektverantwortlicher in der Forschungsgruppe: Dr. Maja Reimann
- Projektpartner:
PD Dr. med. A. Rachow (München)
Dr. med. Florian Marx (Heidelberg)
Prof. Dr. rer. nat. Christof Geldmacher (München)
Dr. rer. nat. Kathrin Held (München)
Dr. rer. nat. Olga Baranov (München)
Prof. Dr. Dr. Jan Rybniker (Köln)
Prof. Dr. med. Susanne Herold (Gießen) - Laufzeit: 2026-2030
BMZ (Bundesministerium für wirtschaftliche Zusammenarbeit und Entwicklung) und EKFS (Else Kröner-Fresenius-Stiftung)
- BREATHE
- Förderer: BMZ and ekfs
- Projektverantwortlicher in der Forschungsgruppe: PD Dr. med. Thomas Theo Brehm
- Projektpartner: PV.N. Karazin Kharkiv National University in Kharkiw, Ukraine
- Laufzeit: 2025 - 2027
- Fördersumme: 200.000 Euro
EU-Projekte
- UNITE4TB
- Förderer: EU-IMI.
- Projektverantwortlicher in der Forschungsgruppe: Prof. C. Lange
- Projektpartner: 27 internationale Projektpartner
- Laufzeit: 2021-2028
S-H Gesellschaft zur Verhütung & Bekämpfung d. Tuberkulose & Lungenkrankheiten e.V
- Access TDMetrics
- Förderer: S-H Gesellschaft zur Verhütung & Bekämpfung d. Tuberkulose & Lungenkrankheiten e.V.
- Projektverantwortlicher in der Forschungsgruppe: Dr. med. Niklas Köhler
- Projektpartner: Universität Hamburg, Institut für Klinische Pharmazie
- Laufzeit: 2023-2026
- Fördersumme: 70.000 Euro
- Validierung eines neuen Biomarkers (TB22) zur Diagnose und zum Therapiemonitoring der Tuberkulose
- Förderer: S-H Gesellschaft zur Verhütung & Bekämpfung d. Tuberkulose & Lungenkrankheiten e.V.
- Projektverantwortlicher in der Forschungsgruppe: Dr. Maja Reimann
- Projektpartner: -/-
- Laufzeit: 2023-2026
- Fördersumme: 60.000 Euro
- Epigenetische und genetische Analyse der Behandlungsergebnisse bei Patientinnen und Patienten mit multiresistenter und medikamentenempfindlicher Tuberkulose
- Förderer: S-H Gesellschaft zur Verhütung & Bekämpfung d. Tuberkulose & Lungenkrankheiten e.V.
- Projektverantwortlicher in der Forschungsgruppe: Dr. Maja Reimann
- Projektpartner:
Prof. Dr. Markus Weckmann (UKSH Lübeck)
Prof. Dr. Folke Brinkmann (UKSH Lübeck) - Laufzeit: 2023-2026
- Auswirkungen der Sputum-basierten und sequenzgesteuerten individualisierten Therapie auf die Behandlungsergebnisse bei arzneimittelresistenter TB (T3 Studie)
- Förderer: S-H Gesellschaft zur Verhütung & Bekämpfung d. Tuberkulose & Lungenkrankheiten e.V.
- Projektverantwortlicher in der Forschungsgruppe: Prof. Dr. Christoph Lange
- Projektpartner: Prof. Dr. Keertan Dheda (Kapstadt, Südafrika)
- Laufzeit: 2023-2026
Niedersächsischer Verein zur Bekämpfung der Tuberkulose, Lungen- und Bronchialerkrankungen e.V.
- detecTB
- Projektverantwortliche in der Forschungsgruppe: PD Dr. med. Thomas Theo Brehm und Dr. med. Niklas Köhler
- Projektpartner: Universitätsklinikum Hamburg-Eppendorf
- Laufzeit: 2025-2027
- Fördersumme: 30.000 Euro
Klinisches Studienmanagement
- Koordination internationaler klinischer Studien zur Entwicklung neuer TB-Medikamente/neuer Therapieregime
- Koordination internationaler Studien zur Entwicklung und Validierung neuer Methoden zur Tuberkulosediagnostik und zum Therapiemonitoring
- Datenbankmanagement
- Epidemiologie und Biostatistik
Pneumologische Expertise für klinische Forschung
- Lungenfunktionsdiagnostik
- Belastungsdiagnostik
- Radiologische Diagnostik
Bronchoskopische Infektionsdiagnostik
- Bronchoalveoläre Lavage (BAL) zur Gewinnung von Zellsuspensionen

Zellbiologische Methoden
- Multicolor-Durchflußzytometrie zur Messung der Expression von zellulären Oberflächenmarkern und/ oder intrazellulären Zytokinen in Blut und aus BAL
- Elutriation zur Präparation von Monozyten/Alveolarmakrophagen (Immunzellanalytik)
- In vitro - Infektion mit M. tuberculosis im S3-Labor und Messung der Wachstumsgeschwindigkeit mit dem Mycobacterium Growth Inhibition Assay
- Identifizierung und Quantifizierung von Lipoarabinomannan (LAM) aus Sputum, Urin, Serum, Plasma und Stuhl
- ELISPOT zum Nachweis IFN-g produzierender T-Zellen
- ELISA zur Quantifizierung von Zytokinen im Zellkulturüberstand
- Multiplex-Analyse ELISA zur Messung von Zytokinen
- Quantitative real-time PCR zur Messung der Cytokin-Expression in BAL oder PBMC
Molekularbiologische Methoden
- Quantitative RT-PCR zum Gen-Nachweis zum Beispiel der Zytokin-Expression in BAL oder PBMC und mykobakterieller DNA
- CRISPR-basierte PCR Technologie zum Nachweis M. tuberculosis-spezifischer DNA aus Blut
- Transkriptomanalysen aus dem peripheren Blut mittels RNAseq und Array-Technik
- Molecular bacterial load assay (MBLA) zum Nachweis von M. tuberculosis-spezifischer RNA aus Sputum, Blut, Ergüssen und Geweben
Therapeutisches Drug Monitoring
- HPLC-MS²-basierte Konzentrationsbestimmung von Amikacin, Amoxicillin, Bedaquilin, Capreomycin, Clavulansäure, Clofazimin, Cycloserin, Delamanid, Ethambutol, Isoniazid, Kanamycin, Levofloxacin, Linezolid, Meropenem, Moxifloxacin, PAS, Prothionamid, Pyrazinamid, Rifabutin, Rifampicin, Streptomycin, Terizidon aus humanem Plasma.
- Modellierung zur Optimierung von Medikamentenkonzentrationen in der klinischen Praxis

Öffentlichkeitsarbeit und Beratungstätigkeit
- Tägliche konsiliarische klinische Beratung (TBinfo Tel. +49(0)4537-1880)
- Wöchentliches TBinfo Board
- Kursus Klinische Tuberkulose
- European Advanced Course for Clinical Tuberculosis
- TBnet-Academy
- DanGerouS Mycobacteria Club (Dänisch-Deutsch-Schwedisches Konsortium)
Auszeichnungen
2026
Oskar-Medizinpreis 2025: Christoph Lange
2025
Habilitationspreis der Republik Moldau: Dumitru Chesov
Michael E. DeBakey, M.D. Excellence in Research Award 2025: Anna Mandalakas
Pneumologie: Beste Kasuistik: Johanna Eggeling
Promotionspreis des Kreises Segeberg: Niklas Köhler
DZIF Posterpreis 2025: Dariusz Wölck
2024
Fellow of the Royal College of Physicians (FRCP): Christoph Lange
2023
Mentor Award: Anna Maria Mandalakas

2022
DGP Forschungspreis 2022: Maja Reimann und Jan Heyckendorf
2026
Ahmad, R, Ramos, JP, Duarte, R, Lange, C & Van Rest, J 2026, 'Enhancing tuberculosis care in lower and middle-income countries through digital adherence technologies', Breathe, Jg. 22, Nr. 1, S. 250173. https://doi.org/10.1183/20734735.0173-2025
Behrens, E, Köhler, N, Münchow, M, Zielinski, N, Pfaffendorf, C, Grobbel, H-P, Schaub, D, Reimann, M, Sánchez Carballo, PM, Kalsdorf, B, Hillemann, D, Kuhns, M, Hofmann-Thiel, S, Hoffmann, H, Decosterd, LA, Choong, E, Aarnoutse, R, Lange, C & Wicha, SG 2026, 'Towards model-informed precision dosing of clofazimine, moxifloxacin, and terizidone/cycloserine in the treatment of drug-resistant tuberculosis: An external model evaluation study', Tuberculosis, Jg. 157, S. 102744. https://doi.org/10.1016/j.tube.2026.102744
de Rioja, VL, Goovaerts, O, Vidal, M, Amuasi, J, Awuah, AA-A, Mwan-Za-K'a, CK, Mbala-Kingebeni, P, Kibambe, RN, Tshitamba, M, Kazadi, C, Yeshaneh, WE, Hunde, DB, Asres, M, Tajebe, F, Massinga, MM, Maphossa, V, Strauss, R, Ascofare, OM, Monnot, F, Lassout, NIZ, Musa, A, ANTICOV-IMMUNO Consortium, Adriaensen, W & Moncunill, G 2026, 'Determinants of long-term SARS-CoV-2 immune responses in asymptomatic-to-moderate COVID-19 patients in sub-Saharan Africa', BMC Medicine, Jg. 24, Nr. 1, S. 44. https://doi.org/10.1186/s12916-025-04607-9
Kirakosyan, O, Verbree, H, van der Zalm, MM, Nightingale, R, Muñoz-Torrico, M, Rossato Silva, D, Singh, SJ, Centis, R, Duarte, R, Akkerman, OW & Migliori, GB 2026, 'Rehabilitation for individuals with post-tuberculosis lung disease', Breathe, Jg. 22, Nr. 1, S. 250056. https://doi.org/10.1183/20734735.0056-2025
Klingmüller, A, Zuber, S, Hoffmann, AM, Köhler, N, Suárez, I, Preßel, T, Niemann, S, Dreyer, V, Decosterd, LA, Choong, E, Schütz, B, Friesen, I & Rybniker, J 2026, 'Therapeutic drug monitoring-guided treatment of XDR TB with an RpoB I491F mutation-a case report', JAC-antimicrobial resistance, Jg. 8, Nr. 1, S. dlaf251. https://doi.org/10.1093/jacamr/dlaf251
Ma'aruf, SY, Sharma, A, Fox, S, Duarte, R, Lange, C & Tiberi, S 2026, 'Management of adverse events in TB care and active TB drug safety monitoring', Breathe, Jg. 22, Nr. 1, S. 250203. https://doi.org/10.1183/20734735.0203-2025
Moreira-Sousa, D, Martins, B, Aguiar, A, Pinheiro, M, Akkerman, OW, Aksamit, TR, Aliberti, S, Andrejak, C, Daley, CL, van Ingen, J, Lange, C, Lipman, M, Loebinger, MR, Jankovic Makek, M, Morimoto, K, Thomson, R, Wagner, D, Winthrop, KL, Yim, J-J & Duarte, R 2026, 'Management of nontuberculous mycobacterial Pulmonary disease refractory to guideline-based therapy: A systematic review', Pulmonology, Jg. 32, Nr. 1, S. 2632467. https://doi.org/10.1080/25310429.2026.2632467
Tulu, B, Brehm, TT, van Crevel, R, Dallenga, T, DiNardo, AR, Dheda, K, Eggeling, J, Enbiale, W, Gröschel, MI, Hao, J, Kumar, V, van Laarhoven, A, Londt, R, Prosser, G, Randall, P, Reiling, N, Rybniker, J, Schaible, UE, Schurr, E, Suarez, I, Theobald, SJ, Wilkinson, RJ & Lange, C 2026, 'Host- and pathogen-related determinants of pulmonary versus extrapulmonary tuberculosis', European Respiratory Review, Jg. 35, Nr. 179. https://doi.org/10.1183/16000617.0174-2025
2025
Adu Gyamfi, CG, Seeger, A, Mulengwa, D, Vasiliu, A, Carratala-Castro, L, Mtafya, B, Maphalala, N, Munguambe, S, Saavedra, B, Ness, T, Maphalala, G, Acacio, S, Mambuque, E, Ehrlich, J, Mejia, R, Ziyane, M, Kirchner, HL, Lange, C, Kay, A, Garcia-Basteiro, AL, Mandalakas, A, DiNardo, AR & Stool4TB Global Partnership 2025, 'Stool-Based Molecular Tuberculosis Treatment Monitoring: A Faster Means for Detecting Persistent Mycobacteria Compared to Phenotypic Culture', Open forum infectious diseases, Jg. 12, Nr. 8, S. ofaf345. https://doi.org/10.1093/ofid/ofaf345
Belheouane, M, Kalsdorf, B, Niemann, S, Gaede, KI, Lange, C, Heyckendorf, J & Merker, M 2025, 'Serratia sp. traits distinguish the lung microbiome of patients with tuberculosis and non-tuberculous mycobacterial lung diseases', PLOS ONE, Jg. 20, Nr. 6, S. e0325362. https://doi.org/10.1371/journal.pone.0325362
Boffa, J, Vambe, D, Khosa, C, José, B, Ndjeka, N, Nkomo, T, Kay, AW, Mandalakas, AM, Mvusi, L, Omar, SV, Thi, S, Velen, K, Charalambous, S & Rangaka, MX 2025, 'TB elimination in Southern Africa: overview and critical reflection', IJTLD open, Jg. 2, Nr. 7, S. 381-387. https://doi.org/10.5588/ijtldopen.25.0050
Brehm, TT, Akkerman, OW, Sotgiu, G, Tiberi, S, Chang, K-C, Dheda, K, Duarte, R, Vambe, D, Udwadia, ZF, Chesov, D, Mendelson, M, Iswari Saktiawati, AM, van Ingen, J, Eyuboglu, FO, Tängdén, T, Quang Vo, LN, Riccardi, N, Moschos, C, Friedland, JS, Lillebaek, T, Chandy, SJ, Caminero, JA, Thwaites, G, Gandra, S, Thursky, K, George, IA, Konstantynovska, O, Fatima, R, Yim, J-J, Kwak, N, Olaru, ID, Gillespie, SH, Kherabi, Y, Perl, SH, Grønningen, E, Rodrigues, C, Bjerrum, S, Bange F, Cox V, Cirillo DM, Saluzzo F, Hara GL, Wagner D, Ismail N, Sloan DJ, Eshun-Wilsonova I, Zeng M, Cantero C, Vasankari T, Mandalakas AM, Kay A, Ness T, Torrico MM, Günther G, Kuksa L, Guglielmetti L, García-Basteiro AL, Marks GB, Pulcini C & Lange C 2025, 'Clinical standards for antimicrobial stewardship in TB care', IJTLD open, Jg. 2, Nr. 12, S. 716-726. https://doi.org/10.5588/ijtldopen.25.0522
Brehm, TT, Köhler, N, Grobbel, H-P, Welling, J, Mandalakas, AM, Fava, V, Schurr, E & Lange, C 2025, 'High risk of drug-resistant tuberculosis in IGRA-negative contacts: should preventive treatment be considered?', Infection. https://doi.org/10.1007/s15010-024-02470-z
Budde, K, Lange, C, Reimann, M, Zielinski, N, Meiwes, L, Köhler, N, Sanchez Carballo, P & DZIF-TB cohort study group 2025, 'A novel method for detecting Lipoarabinomannan in urine with the promise of meeting the WHO target product profile for the diagnosis of tuberculosis', Tuberculosis, Jg. 152, S. 102619. https://doi.org/10.1016/j.tube.2025.102619
Carratalà Castro, L, Munguambe, S, Kay, A, Ssengooba, W, Mulengwa, D, Acácio, S, Ehrlich, J, DiNardo, AR, Vasiliu, A, Seeger, A, Mambuque, E, Adu-Gyamfi, CG, Timoteo, H, Lange, C, Hermans, S, Mandalakas, A, López-Varela, E & García-Basteiro, AL 2025, 'Estimating the Accuracy and Additionality of TB-LAM to Diagnose TB in Children Without HIV (AccuLAM)', CLINICAL INFECTIOUS DISEASES . https://doi.org/10.1093/cid/ciaf525
Carrero Longlax, S, Koster, KJ, Kamat, AM, Lozano, M, Lerner, SP, Hannigan, R, Nishiguchi, T, Abhimanyu, Sheikh, D, Ladki, M, Portillo, A, Koirala, A, Patel, TD, Spieler, Z, Benjamin, AB, Lebedev, M, Ofili, TU, Hutchison, RW, Udeani, G, Opperman, LA, Neal, G, Mandalakas, AM, Netea, MG, Arditi, M, Avalos, P, Grimm, SL, Coarfa, C, Cirillo, JD & DiNardo, AR 2025, 'BCG-Induced DNA Methylation Changes Improve Coronavirus Disease 2019 Vaccine Immunity Without Decreasing the Risk for Severe Acute Respiratory Syndrome Coronavirus 2 Infection', Open forum infectious diseases, Jg. 12, Nr. 1, S. ofaf007. https://doi.org/10.1093/ofid/ofaf007
Chesov, D, Reimann, M, Mukherjee, T, Tewatia, K, Konstantynovska, O, David, A, Rusu, D, Ciobanu, N, Crudu, V & Lange, C 2025, 'High rates of acquired resistance to fluoroquinolones, bedaquiline and linezolid in patients failing treatment against drug-resistant tuberculosis in the Republic of Moldova', CLINICAL MICROBIOLOGY AND INFECTION . https://doi.org/10.1016/j.cmi.2025.09.003
Crudu, V, Chesov, D, Codreanu, A, Turcanu, N, Ciobanu, N, Nepoliuc, L & Rusu, D 2025, 'Diagnostic accuracy study of STANDARD TB-Feron FIA and STANDARD TB-Feron ELISA tests for tuberculosis infection diagnosis in Eastern European setting', Clinical Tuberculosis and Other Mycobacterial Diseases, Jg. 39, S. 100518. https://doi.org/10.1016/j.jctube.2025.100518
Cukoski, S, Brehm, TT, Büttner, S, Van Praet, J, Dolff, S, Eberwein, L, Falces-Romero, I, Cornely, OA, Wanken, M, Müller, R-U, Burst, V & Koehler, FC 2025, 'Design and set-up of the leptospirosis registry LeptoScope for epidemiology, outbreaks and clinical studies on human leptospirosis', Frontiers in public health, Jg. 13, S. 1687249. https://doi.org/10.3389/fpubh.2025.1687249
D'Silva, OA, Lancione, S, Ananthakrishnan, O, Addae, A, Shrestha, S, Alsdurf, H, Thavorn, K, Mzizi, N, Vasilu, A, Kay, A, Mandalakas, AM & Zwerling, AA 2025, 'The catastrophic cost of TB care: Understanding costs incurred by individuals undergoing TB care in low-, middle-, and high-income settings - A systematic review', PLOS global public health, Jg. 5, Nr. 4, S. e0004283. https://doi.org/10.1371/journal.pgph.0004283
DiNardo, AR, Sabiiti, W, Gillespie, SH, Georghiou, SB, Heinrich, N, Hittel, N, Taghlabi, S, Carrero Longlax, D, Kohli, M, Panzner, U, Musia, C, Lange, C, Vasiliu, A, Arts, RJW, Mandalakas, AM, Ruhwald, M, Stuyver, LJ & van Crevel, R 2025, 'Inclusion of patient-centered, non-microbiological endpoints and biomarkers in tuberculosis drug trials', Frontiers in antibiotics, Jg. 4, S. 1570989. https://doi.org/10.3389/frabi.2025.1570989
Dudnyk, A, Lutchmun, W, Duarte, R, Lange, C & Svensson, EM 2025, 'The importance of getting the dose right in the treatment of tuberculosis', Breathe, Jg. 21, Nr. 1, S. 240177. https://doi.org/10.1183/20734735.0177-2024
Epple, H-J, Domaszewska, T, Brünneck, A-CV, Furth, C, Dommerich, S, Lange, C, Schöning, DV, Maschmeyer, G, Bös, L, Schwartz, S, Schneider, T & Mathas, S 2025, 'At the crossroads of infection and malignancy: the challenge of tuberculosis in migrating populations - Case Report and Epidemiologic Analysis', BMC INFECTIOUS DISEASES . https://doi.org/10.1186/s12879-025-12043-6
Essandoh, MN, Mackroth, MS, Brehm, TT, Michelitsch, P, Mbassi, FE, Rakotonirinalaloa, M, Ijagbemi, K & Ramharter, M 2025, 'Malaria risk perceptions and barriers for effective prophylaxis among sub-Saharan African `visiting friends and relatives´ travellers in Hamburg, Germany', Travel medicine and infectious disease, S. 102858. https://doi.org/10.1016/j.tmaid.2025.102858
Feischen, M, Jordan, S, Kalsdorf, B & Schmiedel, S 2025, 'Komplikativer Verlauf einer Infektion mit Mycobacterium marinum – „Nihil nocere“ bei Differenzialdiagnostik und Therapie', Deutsche medizinische Wochenschrift (1946), Jg. 150, Nr. 17, S. 1046-1049. https://doi.org/10.1055/a-2615-9925
Frings, VG, Lâm, T-T, Lange, C, Goebeler, M & Stoevesandt, J 2025, 'Disseminated abscesses due to Mycobacterium wolinskyi and Mycobacterium mageritense: An unusual mixed infection', JAAD case reports, Jg. 61, S. 62-64. https://doi.org/10.1016/j.jdcr.2025.04.024
Garcia-Prats, AJ, Garcia-Cremades, M, Cox, V, Kredo, T, Dunbar, R, Schaaf, HS, Seddon, JA, Furin, J, Achar, J, Radke, K, Sachs, T, Abubakirov, A, Ahmed, S, Akkerman, OW, Al Ani, NA, Amanullah, F, Ahmad, N, Anderson, LF, Asfaw, M, Bango, F, Bauer, T, Becerra, M, Boeree, M, Brinkmann, F, Brown, R, Brust, J, Campbell, JR, Carvalho, AC, Carvalho, I, Cegielski, JP, Centis, R, Chan, ED, Chauhan, S, Chiang, SS, Chan, P-C, D'Ambrosio, L, Dalcolmo, M, Daneilyan, N, de Vries, G, Draper, HR, endTB Study Group, Fairlie, L, Francis, JR, Franke, M, Gegia, M, Restrepo, CG, Guenther, A, Gureva, T, Haecker, B, Harausz, E, Hewison, C, Hicks, RM, Huerga, H, Hughes, J, Isaakidis, P, Syed M, K, Khan, MA, Kotrikadze, T, Kuksa, L, Lachenal, N, Lange, C, Lecca, L, Lopez-Varela, E, Lucena, S, Mariandyshev, A, Mattoo, S, Mendez-Echevarria, A, Migliori, GB, Mitnick, CD, Mohr-Holland, E, Mulanda, W, Murzabakova, T, Myrzalieve, B, Ndjeka, N, Niemann, S, Ozere, I, Padayatchi, N, Parmar, M, Parpieva, N, Manzur-Ul-Alam, M, Rybak, N, Sachdeva, KS, Salmon, K, Santiago-Garcia, B, Schaub, D, Shah, I, Shah, NS, Shah, V, Sharma, S, Shim, TS, Shin, SS, Sinha, A, Skrahina, A, Solanki, H, Solans, BP, Soriano-Arandes, A, Toktogonova, A, van der Werf , TS, Velásquez, GE, Williams, B, Yim, J-J, Savic, R & Hesseling, AC 2025, 'Characteristics of children and adolescents with multidrug-resistant and rifampicin-resistant tuberculosis and their association with treatment outcomes: a systematic review and individual participant data meta-analysis', Lancet child & adolescent health, Jg. 9, Nr. 2, S. 100-111. https://doi.org/10.1016/S2352-4642(24)00330-4
Goletti, D, Cirillo, DM, Lange, C, Tiberi, S, Günther, G, Petrone, L, Kuksa, L, Opota, O, Akkerman, O, Podlekareva, D, Guglielmetti, L & Duarte, R 2025, 'The Empty Medicine Cabinet: Urgent Action Needed to Resolve TB Drug Shortages in Europe', INTERNATIONAL JOURNAL OF INFECTIOUS DISEASES , S. 108022. https://doi.org/10.1016/j.ijid.2025.108022
Guglielmetti, L, Khan, U, Velásquez, GE, Gouillou, M, Ali, MH, Amjad, S, Kamal, F, Abubakirov, A, Ardizzoni, E, Baudin, E, Bektassov, S, Berry, C, Bonnet, M, Chavan, V, Coutisson, S, Dakenova, Z, de Jong, BC, Dinh, LV, Ferlazzo, G, Kirakosyan, O, Lachenal, N, Lecca, L, McIlleron, H, Mikanda, KK, Mucching-Toscano, S, Mulders, W, Mushtaque, H, Nahid, P, Nguyen, DV, Nguyen, NV, Oyewusi, L, Motta, I, Panda, S, Patil, S, Pham, TH, Phan, DT, Phan, HTT, Phillips, PPJ, Ruiz, J, Rupasinghe, P, Salahuddin, N, Sanchez-Garavito, E, Seung, KJ, Asfaw, MT, Vargas Vasquez, D, Rich, ML, Varaine, F, Mitnick, CD & endTB-Q Clinical Trial Team 2025, 'Bedaquiline, delamanid, linezolid, and clofazimine for rifampicin-resistant and fluoroquinolone-resistant tuberculosis (endTB-Q): an open-label, multicentre, stratified, non-inferiority, randomised, controlled, phase 3 trial', Lancet Respiratory Medicine. https://doi.org/10.1016/S2213-2600(25)00194-8
Hoelscher, M, Barros-Aguirre, D, Dara, M, Heinrich, N, Sun, E, Lange, C, Tiberi, S & Wells, C 2025, 'Corrigendum to "Candidate anti-tuberculosis medicines and regimens under clinical evaluation" [Clin Microbiol Infect 30(9) (2024) 1131-1138]', CLINICAL MICROBIOLOGY AND INFECTION . https://doi.org/10.1016/j.cmi.2025.10.001
Heinrich, F, Wong, TLE, Graf, W, Dost, K, Brennecke, A, Kowalski, V, van Rüth, V, Iwersen-Bergmann, S, Hajek, A, König, H-H, Renné, T, Brehm, TT, Pfefferle, S, Schulze Zur Wiesch, J, Dandri, M, Aepfelbacher, M, Püschel, K, Ondruschka, B, Lütgehetmann, M & Stallbaum, F 2025, 'Prevalence and risk factors of viral hepatitis and HIV among people experiencing homelessness in Germany based on a nationwide study', Scientific Reports, Jg. 15, Nr. 1, S. 32571. https://doi.org/10.1038/s41598-025-18552-3
Idris, R, Urschel, R, Lange, C & Sester, M 2025, 'Evidenzbasierter Einsatz von Interferon-Gamma Release Assays in der Tuberkulosediagnostik', Zeitschrift für Pneumologie. https://doi.org/10.1007/s10405-025-00651-7
Inman, B, Butler, J, George-Nichol, S, Kovalenko, G, Savidge, T, Vergnetti, Y, Pongratz, C, Bee, E, DiNardo, AR, Kay, A, Mandalakas, A, Bortz, E & Ness, TE 2025, 'Application of FreezeTB, a targeted nanopore sequencing assay, for identification of drug resistance and lineages among pulmonary tuberculosis cases in Alaska', Microbiology spectrum, S. e0233525. https://doi.org/10.1128/spectrum.02335-25
Kasule, GW, Hermans, S, Acacio, S, Kay, A, Nsubuga, JK, Fernández-Escobar, C, Shiba, N, Carratalá-Castro, L, Semugenze, D, Mwachan, P, Munguambe, S, Ehrlich, J, Lopez-Varela, E, DiNardo, AR, Cobelens, F, Lange, C, Joloba, M, Mandalakas, AM, Ssengooba, W, García-Basteiro, AL & Stool4TB Global Partnership 2025, 'Performance of stool Xpert MTB/RIF Ultra for detection of Mycobacterium tuberculosis among adults living with HIV: a multicentre, prospective diagnostic study', The Lancet. Microbe, S. 101085. https://doi.org/10.1016/j.lanmic.2025.101085
Kherabi, Y, Skouvig Pedersen, O, Lange, C, Chesov, D, Bénézit, F, Codecasa, LR, Dudnyk, A, Kiria, N, Konstantynovska, O, Marigot-Outtandy, D, Panciu, T-C, Poignon, C, Sasi, S, Schaub, D, Solodovnikova, V, Vasiliauskaitè, L, Yeghiazaryan, L, Günther, G, Guglielmetti, L & TBnet/ESGMYC XDR-TB Study Group 2025, 'Treatment outcomes of extensively drug-resistant tuberculosis in Europe: a retrospective cohort study', The Lancet regional health. Europe, Jg. 56, S. 101380. https://doi.org/10.1016/j.lanepe.2025.101380
Kirakosyan, O, Reimann, M, Andersen, AB, Bjarnason, A, Bakos, Á, Dyrhol-Riise, AM, McLaughlin, AM, Nita, C, Pieridou, D, Chesov, D, Davidavičienė, EV, Günther, G, Atshemyan, H, Muylle, I, Solovic, I, Bruchfeld, J, Manika, K, Kuksa, L, Codecasa, LR, Stosic, M, Skowroński, M, Makek, MJ, Fréchet Jachym, M, Knappik, M, Santin, M, Yatskevich, N, Konstantynovska, O, Akkerman, O, Svetina, P, Viiklepp, P, Duarte, R, Zeynel, S, Togonidze, T, Vasankari, T, Parris, V, Özkara, Ş, Lange, C & Brehm, TT 2025, 'Use of putative hepatoprotective agents as an adjunct to anti-TB treatment in Europe', IJTLD open, Jg. 2, Nr. 2, S. 101-106. https://doi.org/10.5588/ijtldopen.24.0498
Konstantynovska, O, Synenko, T, Honcharenko, A, Volobuieva, O, Liadova, T, Reimann, M, Lange, C & Chesov, D 2025, 'Fluoroquinolone Resistance in Drug-Resistant Tuberculosis, Kharkiv, Ukraine, 2019–2023', EMERGING INFECTIOUS DISEASES, Jg. 31, Nr. 3, 31 (3), S. 615-617. https://doi.org/10.3201/eid3103.241675
Köhler, N, Otto-Knapp, R, Heinrich, N, Lange, C & Brehm, TT 2025, 'Therapie der Tuberkulose bei Erwachsenen', Deutsche medizinische Wochenschrift (1946), Jg. 150, Nr. 20, S. 1207-1215. https://doi.org/10.1055/a-2612-2364
Kuksa, L, Andrejak, C, Haecker, B, Bothamley, G, Calcagno, A, Cirillo, DM, Duarte, R, Fatima, R, Ferlazzo, G, Guglielmetti, L, Günther, G, Hewison, C, Horsburgh, CR, Jäger, T, Kalancha, Y, Otto-Knapp, R, Kranzer, K, Lillebaek, T, Marks, G, Middelkoop, K, Motta, I, Rabinova, V, Sommerfeld, P, Tattevin, P & Lange, C 2025, 'Urgent request for pretomanid label expansion to align with WHO guidelines and improve treatment accessibility and efficacy', IJTLD open, Jg. 2, Nr. 3, S. 117-119. https://doi.org/10.5588/ijtldopen.25.0152
Lange, B, Brehm, TT, Arend, SM, Arias-Guillén, M, Bakker, M, Berastegui, C, Babiker, M, Charif, R, Duarte, R, Flick, H, Hofland, RW, Ismail, J, Kniepeiss, D, Krepel, J, Krishnan, N, Kuijpers, DL, Kunst, H, van Leth, F, Lezaic, V, Los-Arcos, I, Machová, J, Milburn, H, Morais, SA, Kon, OM, Osoro-Suarez, C, Pessegueiro Miranda, H, Pesut, D, Rahman, A, Reischig, T, Sánchez-Montalvá, A, Spohn, HE, Stegenga, MT, de Vries, APJ, Wagner, D, Wobser, R, Lange, C & Sester, M 2025, 'Tuberculosis incidence in solid organ transplant recipients in Europe: A multicenter TBnet cohort study', Journal of infection, Jg. 92, Nr. 1, S. 106668. https://doi.org/10.1016/j.jinf.2025.106668
Lange, C, Barry, C & Sotgiu, G 2025, 'Linezolid for the treatment of drug-resistant tuberculosis', The European respiratory journal, Jg. 66, Nr. 2. https://doi.org/10.1183/13993003.00927-2025
Lange, C, Bothamley, G, Günther, G, Guglielmetti, L, Kontsevaya, I, Kuksa, L, Lange, B, Lorent, N, Saluzzo, F, Sester, M, Tebruegge, M, Tunesi, S, Tweed, C & Tuberculosis Network European Trials group (TBnet) 2025, 'A Year in Review on Tuberculosis and Non-tuberculous Mycobacteria Disease: A 2025 Update for Clinicians and Scientists', Pathogens and Immunity, Jg. 10, Nr. 2, S. 1-45. https://doi.org/10.20411/pai.v10i2.791
Lange, C, Schaberg, T, Otto-Knapp, R & für die Autorinnen und Autoren der Tuberkulose-Leitliniengruppe für Deutschland, Österreich und die Schweiz: 2025, 'Update: Therapie der medikamentenresistenten Tuberkulose (DR-TB) in Deutschland, Österreich und der Schweiz', Pneumologie (Stuttgart, Germany). https://doi.org/10.1055/a-2731-0729
Leo, F, Polsfuss, S, Przewosnik, A-S, Grohé, C & Lange, C 2025, 'Mycobacterium florentinum pulmonary disease: a case report and review of the literature', BMC INFECTIOUS DISEASES . https://doi.org/10.1186/s12879-025-12321-3
Lima, AV, Acácio, S, Cossa, H, Hermans, S, Kay, A, Ssengooba, W, Mandalakas, A, Lange, C, Garcia-Basteiro, A, Munguambe, K & Stool4 TB Global Partnership 2025, 'Perceived usability, acceptability, and feasibility of stool-based qPCR TB diagnostics: perspectives from healthcare providers in Manhiça District, southern Mozambique', BMC INFECTIOUS DISEASES , Jg. 25, Nr. 1, S. 757. https://doi.org/10.1186/s12879-025-11117-9
Lima, AV, Cossa, H, Djive, H, Cossa, O, Cumbe, M, Acácio, S, Nkala, B, Nsubuga Kikoyo, J, Carratala-Castro, L, Ehrlich, J, Hermans, S, Kay, A, Ssengooba, W, Mandalakas, A, Lange, C, Enguita-Fernàndez, C, Munguambe, K, Garcia-Basteiro, AL & Stool4TB Global Partnership 2025, 'Gaps in TB-related knowledge and practices: An assessment of health care seeking behavior among adults with HIV and caregivers of paediatric patients with presumptive TB symptoms in Manhiça district, southern Mozambique', PLOS global public health, Jg. 5, Nr. 8, S. e0004734. https://doi.org/10.1371/journal.pgph.0004734
Madison, M, Vambe, D, Thi, SS, Ziyane, M, Shiba, N, Nkala, BB, Ness, T, Lima, AV, Dlamini, S, Ngwenya, S, Mandalakas, A & Kay, A 2025, 'Healthcare providers' knowledge, attitudes, and perceptions from using targeted sequencing to diagnose and manage drug-resistant tuberculosis (DR-TB) in Eswatini', PLOS global public health, Jg. 5, Nr. 6, S. e0004718. https://doi.org/10.1371/journal.pgph.0004718
Mandalakas, AM, Casenghi, M & Zwerling, A 2025, 'Childhood tuberculosis: robust funding and integrated solutions needed now', Lancet child & adolescent health. https://doi.org/10.1016/S2352-4642(25)00245-7
Mischnik, A, Kuhns, M, Meiwes, L, Pichlo, S, Gaudlitz, J, Zielinski, N & Brehm, TT 2025, 'Neue Methoden der Tuberkulose-Diagnostik', Deutsche medizinische Wochenschrift (1946), Jg. 150, Nr. 20, S. 1198-1206. https://doi.org/10.1055/a-2612-2417
Moreira-Sousa, D, Martins, B, Aguiar, A, Pinheiro, M, Akkerman, O, Aksamit, TR, Aliberti, S, Andrejak, C, Daley, CL, van Ingen, J, Lange, C, Lipman, M, Loebinger, MR, Jankovic Makek, M, Morimoto, K, Thomson, RM, Wagner, D, Winthrop, KL, Yim, J-J & Duarte, R 2025, 'Consensus on Management of Refractory Nontuberculous Mycobacterial Pulmonary Disease', The European respiratory journal. https://doi.org/10.1183/13993003.00400-2025
Ness, TE, Ziyane, M, Maphalala, N, Seeger, A, Vasiliu, A, Khumalo, W, Thunzini, M, Dlamini, S, Maphalala, G, Gascua, C, Lange, C, Meyer, S, Inman, B, Dreyer, V, Utpatel, C, Niemann, T, DiNardo, A, Kay, A, Niemann, S & Mandalakas, A 2025, 'Screening and targeted sequencing of stool for microbiologic confirmation and drug resistance determination in paucibacillary tuberculosis', PLOS global public health, Jg. 5, Nr. 11, S. e0005243. https://doi.org/10.1371/journal.pgph.0005243
Nkala, BB, Kay, A, Vasiliu, A, Mandalakas, A, Nkomo, T, Mdluli-Dlamini, L, Ngwenya, S, Thi, SS, Masina, S, Sibanda, J, Tsela, S & Vambe, D 2025, 'An assessment of video-observed treatment as an adherence support tool for patients with drug-resistant TB', IJTLD open, Jg. 2, Nr. 12, S. 763-768. https://doi.org/10.5588/ijtldopen.25.0370
Nkomo, T, Udwadia, Z, Vambe, D, van Rie, A, Thi, SS, Stillo, J, Stambekova, A, Sinha, A, Rich, ML, Reuter, A, Patel, J, Otto-Knapp, R, Motta, I, Mesic, A, McKenna, L, Maru, S, Lessem, E, Lange, C, Kiria, N, Kherabi, Y, Günther, G, Guglielmetti, L, Decroo, T, Chen, L, Ashesh, A, Abubakirov, A & Furin, J 2025, 'Clinical best practices for caring for people with expanded resistance to newer TB drugs', IJTLD open, Jg. 2, Nr. 6, S. 315-323. https://doi.org/10.5588/ijtldopen.25.0240
Peterka, M, Krieger, D, Khatamzas, E, Denkinger, C, Köhler, N, Lange, C, Macholz, M, Lübbert, C, Daller, S, Knappik, M, Kuhns, M, Häcker, B, Polsfuß, S, Bauer, T & Otto-Knapp, R 2025, 'Safety of high dose bedaquiline treatment in extensively drug-resistant (XDR)-TB patients', The European respiratory journal. https://doi.org/10.1183/13993003.01496-2025
Pichlo, S, Carballo, PS, Reimann, M, Zielinski, N, Shuaib, YA, Köhler, N, Andres, S, Heyckendorf, J, Kalsdorf, B, Olaru, ID, Salzer, HJF & Lange, C 2025, 'Lipoarabinomannan (LAM) for the diagnosis of tuberculosis from sputum', Journal of infection, Jg. 91, Nr. 6, S. 106662. https://doi.org/10.1016/j.jinf.2025.106662
Pinheiro, M, Aguiar, A, Moreira, DN, Akkerman, OW, Al-Suwaidi, Z, Alffenaar, J-WC, Arandjelović, I, Brito, U, de Colombani, P, Curcic, R, Garcia-Basteiro, AL, Goletti, D, Günther, G, Ibraim, E, Kapata, N, Lange, C, Lipman, M, Jankovic Makek, M, Marais, BJ, Mariandyshev, A, Magis-Escurra, C, Migliori, GB, Sánchez Montalvá, A, Nanovic, Z, Palmero, DJ, Priwitzer, M, Raviglione, MCB, Silva, DR, Salzer, HJF, Schwarzbach, C, Spruijt, I, Winthrop, KL, Udwadia, Z, Vasankari, T, Vilaplana, C & Duarte, R 2025, 'A multinational Delphi consensus on tuberculosis screening of migrants in Europe', ERJ Open Research, Jg. 11, Nr. 6. https://doi.org/10.1183/23120541.00574-2025
Reimann, M, Avsar, K, DiNardo, AR, Goldmann, T, Günther, G, Hoelscher, M, Ibraim, E, Kalsdorf, B, Kaufmann, SHE, Köhler, N, Mandalakas, AM, Maurer, FP, Müller, M, Nitschkowski, D, Olaru, ID, Popa, C, Rachow, A, Rolling, T, Salzer, HJF, Sanchez-Carballo, P, Schuhmann, M, Schaub, D, Spinu, V, Terhalle, E, Unnewehr, M, Zielinski, NJ, Heyckendorf, J & Lange, C 2025, 'The TB27 Transcriptomic Model for Predicting Mycobacterium tuberculosis Culture Conversion', Pathogens and Immunity, Jg. 10, Nr. 1, S. 120-139. https://doi.org/10.20411/pai.v10i1.770
Sester, M, Altet-Gomez, N, Andersen, ÅB, Arias-Guillén, M, Avsar, K, Bakken Kran, A-M, Bothamley, G, Nordholm Breschel, AC, Brown, J, Chesov, D, Ciobanu, N, Cirillo, DM, Crudu, V, de Souza Galvao, M, Dilektasli, AG, Dominguez, J, Duarte, R, Dyrhol-Riise, AM, Goletti, D, Hoffmann, H, Ibraim, E, Kalsdorf, B, Krawczyk, M, Kunst, H, Lange, B, Lipman, M, Matteelli, A, Milkiewicz, P, Neyer, D, Nitschke, M, Oral, HB, Palacios-Gutiérrez, JJ, Petruccioli, E, Raszeja-Wyszomirska, J, Ravn, P, Rupp, J, Spohn, H-E, Toader, C, Villar-Hernandez, R, Wagner, D, van Leth, F, Martinez, L, Pedersen, OS & Lange, C 2025, 'Correction to Diagnostic accuracy and predictive value of the QuantiFERON-TB gold plus assay for tuberculosis in immunocompromised individuals: a prospective TBnet study Lancet Reg Health Eur 57 (2025) 101416 LLRHEUROPE-D-25-00310', The Lancet regional health. Europe, Jg. 59, S. 101523. https://doi.org/10.1016/j.lanepe.2025.101523
Sester, M, Altet-Gomez, N, Andersen, ÅB, Arias-Guillén, M, Avsar, K, Bakken Kran, A-M, Bothamley, G, Nordholm Breschel, AC, Brown, J, Chesov, D, Ciobanu, N, Cirillo, DM, Crudu, V, de Souza Galvao, M, Dilektasli, AG, Dominguez, J, Duarte, R, Dyrhol-Riise, AM, Goletti, D, Hoffmann, H, Ibraim, E, Kalsdorf, B, Krawczyk, M, Kunst, H, Lange, B, Lipman, M, Matteelli, A, Milkiewicz, P, Neyer, D, Nitschke, M, Oral, HB, Palacios-Gutiérrez, JJ, Petruccioli, E, Raszeja-Wyszomirska, J, Ravn, P, Rupp, J, Spohn, H-E, Toader, C, Villar-Hernandez, R, Wagner, D, van Leth, F, Martinez, L, Pedersen, OS & Lange, C 2025, 'Diagnostic accuracy and predictive value of the QuantiFERON-TB gold plus assay for tuberculosis in immunocompromised individuals: a prospective TBnet study', The Lancet regional health. Europe, Jg. 57, S. 101416. https://doi.org/10.1016/j.lanepe.2025.101416
Tchakounte Youngui, B, Tchounga, BK, Atwine, D, Vasiliu, A, Cuer, B, Simo, L, Okello, R, Tchendjou, P, Kuate Kuate, A, Turyahabwe, S, Cohn, J, Graham, SM, Casenghi, M & Bonnet, M 2025, 'Safety of 3-month rifampicin-isoniazid TPT in child household contacts in a community-based intervention', INTERNATIONAL JOURNAL OF TUBERCULOSIS AND LUNG DISEASE, Jg. 29, Nr. 2, S. 67-74. https://doi.org/10.5588/ijtld.24.0311
Vasiliu, A, Carratala-Castro, L, Seeger, A, Ehrlich, J, Nkala, B, Ness, T, Cumbe, MM, Mulengwa, D, Munguambe, S, Mtafya, B, Mambuque, E, Shiba, N, Acacio, S, Komba, L, Adu-Gyamfi, CG, Kirchner, HL, Lange, C, DiNardo, AR, Garcia-Basteiro, A, Mandalakas, AM, Kay, A & Stool4TB Global Partnership 2025, 'Performance of a novel stool quantitative polymerase chain reaction assay for pediatric tuberculosis detection in sub-Saharan Africa', Journal of the Pediatric Infectious Diseases Society. https://doi.org/10.1093/jpids/piaf045
Vasiliu, A, Cristea, V, Stoycheva, K, Rosales-Klintz, S, Lange, C, Zenner, D & Ködmön, C 2025, 'Shifting tuberculosis dynamics in the EU/EEA: geographical and drug resistance trends among people of foreign origin, 2019 to 2023', Eurosurveillance, Jg. 30, Nr. 11. https://doi.org/10.2807/1560-7917.ES.2025.30.11.2500173
Vonasek, BJ, Marcy, O, Armour, J, Casenghi, M, Cazes, C, Chisti, MJ, d'Elbée, M, Huerga, H, Hewison, C, Lancioni, CL, Lungu, PS, McCollum, ED, Musiime, V, Mvalo, T, Seddon, JA, Steenhoff, AP, Thomas, TA, Tovar, M, Vasiliu, A, Garcia-Prats, A & Chabala, C 2025, 'Leveraging nutritional rehabilitation and tuberculosis programmes to tackle tuberculosis and severe acute malnutrition in children', Lancet child & adolescent health. https://doi.org/10.1016/S2352-4642(25)00062-8
Woelk, D, Meiwes, L, Ciobanu, N, Crudu, V, Comanac, A-M, Kulcitkaia, S, Vasiliu, A, Mandalakas, AM, Lange, C, Brehm, TT & Chesov, D 2025, 'Non-invasive diagnosis of pulmonary tuberculosis using face mask sampling: A prospective study in adults', CLINICAL MICROBIOLOGY AND INFECTION . https://doi.org/10.1016/j.cmi.2025.12.017
Youngquist, BM, Saliba, J, Kim, Y, Cutro, TJ, Lyon, CJ, Olivo, J, Ha, N, Fine, J, Colman, R, Vergara, C, Robinson, J, LaCourse, S, Garfein, RS, Catanzaro, DG, Lange, C, Perez-Then, E, Graviss, EA, Mitchell, CD, Rodwell, T, Ning, B & Hu, TY 2025, 'Rapid tuberculosis diagnosis from respiratory or blood samples by a low cost, portable lab-in-tube assay', Science translational medicine, Jg. 17, Nr. 793, S. eadp6411. https://doi.org/10.1126/scitranslmed.adp6411
Zielinski, N, Brehm, TT, Köhler, N, Sánchez Carballo, P, Schaub, D, Lange, C & Reimann, M 2025, 'Analysis of gene expression in patients prior to TB treatment to identify those associated with pyrazinamide-hepatotoxicity', IJTLD open, Jg. 2, Nr. 8, S. 497-499. https://doi.org/10.5588/ijtldopen.25.0189
2024
Abhimanyu, Longlax, SC, Nishiguchi, T, Ladki, M, Sheikh, D, Martinez, AL, Mace, EM, Grimm, SL, Caldwell, T & Portillo Varela, A et al. 2024, 'TCA metabolism regulates DNA hypermethylation in LPS and Mycobacterium tuberculosis-induced immune tolerance', PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCES OF THE UNITED STATES OF AMERICA, Jg. 121, Nr. 41, S. e2404841121. https://doi.org/10.1073/pnas.2404841121
Argel, M, Conde, M, Vieira, M, Lange, C, Magis-Escurra, C & Duarte, R 2024, 'Screening of refugees from Ukraine for TB: a TBnet survey', INTERNATIONAL JOURNAL OF TUBERCULOSIS AND LUNG DISEASE, Jg. 28, Nr. 4, S. 202-203. https://doi.org/10.5588/ijtld.23.0447
Brehm, TT, Reimann, M, Köhler, N & Lange, C 2024, '(Re-)introduction of TNF antagonists and JAK inhibitors in patients with previous tuberculosis: a systematic review', CLINICAL MICROBIOLOGY AND INFECTION , Jg. 30, Nr. 8, S. 989-998. https://doi.org/10.1016/j.cmi.2024.04.011
Brehm, TT, Shijaku, F, Krumkamp, R, Jochum, J, Hoffmann, A, Ramharter, M & Kreuels, B 2024, 'Influenza in travelers from Germany returning from abroad: a retrospective case-control study', BMC INFECTIOUS DISEASES , Jg. 24, Nr. 1, S. 1107. https://doi.org/10.1186/s12879-024-10008-9
Carow, B, Muliadi, V, Skålén, K, Yokota, C, Kathamuthu, GR, Setiabudiawan, TP, Lange, C, Scheu, K, Gaede, KI & Goldmann, T et al. 2024, 'Immune mapping of human tuberculosis and sarcoidosis lung granulomas', FRONTIERS IN IMMUNOLOGY, Jg. 14, S. 1332733. https://doi.org/10.3389/fimmu.2023.1332733
Carratalà-Castro, L, Munguambe, S, Saavedra-Cervera, B, de Haas, P, Kay, A, Marcy, O, Nabeta, P, Ssengooba, W, Ghimenton-Walters, E & Acácio, S et al. 2024, 'Performance of stool-based molecular tests and processing methods for paediatric tuberculosis diagnosis: a systematic review and meta-analysis', The Lancet. Microbe, S. 100963. https://doi.org/10.1016/j.lanmic.2024.100963
Carratalà-Castro, L, Ssengooba, W, Kay, A, Acácio, S, Ehrlich, J, DiNardo, AR, Shiba, N, Nsubuga, JK, Munguambe, S & Saavedra-Cervera, B et al. 2024, 'A stool based qPCR for the diagnosis of TB in children and people living with HIV in Uganda, Eswatini and Mozambique (Stool4TB): a protocol for a multicenter diagnostic evaluation', BMC INFECTIOUS DISEASES , Jg. 24, Nr. 1, S. 233. https://doi.org/10.1186/s12879-023-08708-9
Cirillo, D, Anthony, R, Gagneux, S, Horsburgh, CR, Hasan, R, Darboe, S, Laniado-Laborin, R, Probandari, A, Tukvadze, N & Arcêncio, RA et al. 2024, 'A successful UN High-Level Meeting on antimicrobial resistance must build on the 2023 UN High-Level Meeting on tuberculosis', The Lancet. Global health, Jg. 12, Nr. 8, S. e1225-e1226. https://doi.org/10.1016/S2214-109X(24)00229-8
Dheda, K & Lange, C 2024, 'Towards shorter, safer, flexible, and more effective treatment regimens for drug-resistant tuberculosis', Lancet Respiratory Medicine. https://doi.org/10.1016/S2213-2600(24)00300-X
Dheda, K, Mirzayev, F, Cirillo, DM, Udwadia, Z, Dooley, KE, Chang, K-C, Omar, SV, Reuter, A, Perumal, T & Horsburgh, CR et al. 2024, 'Multidrug-resistant tuberculosis', Nature reviews. Disease primers, Jg. 10, Nr. 1, S. 22. https://doi.org/10.1038/s41572-024-00504-2
Diacon, AH, Barry, CE, Carlton, A, Chen, RY, Davies, M, de Jager, V, Fletcher, K, Koh, GCKW, Kontsevaya, I & Heyckendorf, J et al. 2024, 'A first-in-class leucyl-tRNA synthetase inhibitor, ganfeborole, for rifampicin-susceptible tuberculosis: a phase 2a open-label, randomized trial', NATURE MEDICINE , Jg. 30, Nr. 3, S. 896-904. https://doi.org/10.1038/s41591-024-02829-7
Donald, PR, Kaufmann, SHE, Schaub, D, Thee, S & Lange, C 2024, 'Carl Flügge, one of the last holistic hygienists and discoverer of droplet transmission of infectious diseases', MEDICAL MICROBIOLOGY AND IMMUNOLOGY, Jg. 213, Nr. 1, S. 17. https://doi.org/10.1007/s00430-024-00801-3
Eggeling, J, Kalsdorf, B, Schaub, D, Schierholz, S, Hammerl, P, Nowak, D & Lange, C 2024, 'Alles unter Kontrolle?', Pneumologie (Stuttgart, Germany). https://doi.org/10.1055/a-2313-4137
Eggeling, J, Ramharter, M, Wichmann, D & Schmiedel, S 2024, 'Schwere komplizierte Malaria durch Plasmodium falciparum bei einer Reiserückkehrerin aus Sansibar', Deutsche medizinische Wochenschrift (1946), Jg. 149, Nr. 18, S. 1090-1093. https://doi.org/10.1055/a-2359-7083
Fischer, C, Siakavara, M, Alter, P, Vogelmeier, CF, Speicher, T, Pott, H, Watz, H, Bals, R, Trudzinski, F, Herth, F, Ficker, JH, Wagner, M, Lange, C, Stoycheva, K, Randerath, W, Behr, J, Fähndrich, S, Welte, T, Pink, I, Kahnert, K, Seeger, W, Kuhnert, S, Gessler, T, Adaskina, N & Jörres, RA 2024, 'Association of Patients' Knowledge on the Disease and Its Management with Indicators of Disease Severity and Individual Characteristics in Patients with Chronic Obstructive Pulmonary Disease (COPD): Results from COSYCONET 2', Patient preference and adherence, Jg. 18, S. 2383-2393. https://doi.org/10.2147/PPA.S488165
Gillespie, SH, DiNardo, AR, Georghiou, SB, Sabiiti, W, Kohli, M, Panzner, U, Kontsevaya, I, Hittel, N, Stuyver, LJ & Tan, JB et al. 2024, 'Developing biomarker assays to accelerate tuberculosis drug development: defining target product profiles', The Lancet. Microbe, Jg. 5, Nr. 9, S. 100869. https://doi.org/10.1016/S2666-5247(24)00085-5
Goscé, L, Allel, K, Hamada, Y, Surkova, E, Kontsevaya, I, Wang, TT, Liu, W-H, Matveev, A, Ziganshina, LE & Korobitsyn, A et al. 2024, 'Systematic review of the economic impact of novel Mycobacterium tuberculosis specific antigen-based skin tests for detection of TB infection compared with tuberculin skin test and interferon-gamma release assays', PLOS global public health, Jg. 4, Nr. 10, S. e0003655. https://doi.org/10.1371/journal.pgph.0003655
Günther, G, Guglielmetti, L, Kherabi, Y, Duarte, R, Lange, C & Tuberculosis Network European Trials group 2024, 'Availability of drugs and resistance testing for bedaquiline, pretomanid, linezolid, and moxifloxacin (BPaL(M)) regimen for rifampicin-resistant tuberculosis in Europe', CLINICAL MICROBIOLOGY AND INFECTION , Jg. 30, Nr. 9, S. 1197.e1-1197.e4. https://doi.org/10.1016/j.cmi.2024.03.009
Hauptmann, M, Kalsdorf, B, Akoh-Arrey, JE, Lange, C & Schaible, UE 2024, 'Microbiota alterations in patients treated for susceptible or drug-resistant TB', IJTLD open, Jg. 1, Nr. 8, S. 355-361. https://doi.org/10.5588/ijtldopen.24.0325
Hoelscher, M, Barros-Aguirre, D, Dara, M, Heinrich, N, Sun, E, Lange, C, Tiberi, S & Wells, C 2024, 'Candidate anti-tuberculosis medicines and regimens under clinical evaluation', CLINICAL MICROBIOLOGY AND INFECTION , Jg. 30, Nr. 9, S. 1131-1138. https://doi.org/10.1016/j.cmi.2024.06.016
Holmberg, P, Janoušková, M, Schmidt, T, Neumann, A, Olsson, O, Isberg, P-E, Reimann, M, Riesbeck, K, Skogmar, S & Björkman, P 2024, 'Blood levels of Mycobacterium tuberculosis (Mtb)antigen-triggered immune markers in people exposed to tuberculosis with regard to Mtb infection status and receipt of tuberculosis preventive therapy', Tuberculosis, Jg. 151, S. 102595. https://doi.org/10.1016/j.tube.2024.102595
James, LP, Klaassen, F, Sweeney, S, Furin, J, Franke, MF, Yaesoubi, R, Chesov, D, Ciobanu, N, Codreanu, A & Crudu, V et al. 2024, 'Impact and cost-effectiveness of the 6-month BPaLM regimen for rifampicin-resistant tuberculosis in Moldova: A mathematical modeling analysis', PLoS medicine, Jg. 21, Nr. 5, S. e1004401. https://doi.org/10.1371/journal.pmed.1004401
Kasule, GW, Hermans, S, Semugenze, D, Wekiya, E, Nsubuga, J, Mwachan, P, Kabugo, J, Joloba, M, García-Basteiro, AL & Ssengooba, W et al. 2024, 'Non-sputum-based samples and biomarkers for detection of Mycobacterium tuberculosis: the hope to improve childhood and HIV-associated tuberculosis diagnosis', EUROPEAN JOURNAL OF MEDICAL RESEARCH , Jg. 29, Nr. 1, S. 502. https://doi.org/10.1186/s40001-024-02092-z
Kay, A, Lukhele, B, Dlamini, S, Seeger, A, Dlamini, P, Ndabezitha, S, Mthethwa, N, Steffy, T, Komba, L & Amuge, P et al. 2024, 'Predicting mortality within 1 year of ART initiation in children and adolescents living with HIV in sub-Saharan Africa: a retrospective observational cohort study', The Lancet. Global health, Jg. 12, Nr. 6, S. e929-e937. https://doi.org/10.1016/S2214-109X(24)00091-3
Kay, A, Vasiliu, A, Carratala-Castro, L, Mtafya, B, Mendez Reyes, JE, Maphalala, N, Munguambe, S, Mulengwa, D, Ness, T & Saavedra, B et al. 2024, 'Performance of a stool-based quantitative PCR assay for the diagnosis of tuberculosis in adolescents and adults: a multinational, prospective diagnostic accuracy study', The Lancet. Microbe, Jg. 5, Nr. 5, S. e433-e441. https://doi.org/10.1016/S2666-5247(23)00391-9
Kunst, H, Lange, B, Hovardovska, O, Bockey, A, Zenner, D, Andersen, AB, Hargreaves, S, Pareek, M, Friedland, JS, Wejse, C, Bothamley, G, Guglielmetti, L, Chesov, D, Tiberi, S, Matteelli, A, Mandalakas, AM, Heyckendorf, J, Eimer, J, Malhotra, A, Zamora, J, Vasiliu, A, Lange, C & European Tuberculosis Network TBNET 2024, 'Tuberculosis in adult migrants in Europe: a TBnet consensus statement', The European respiratory journal. https://doi.org/10.1183/13993003.01612-2024
Lange, C, Kherabi, Y, Guglielmetti, L, Duarte, R, Günther, G & Tuberculosis Network European Trials group 2024, 'Availability of drugs and resistance testing for bedaquiline, pretomanid, linezolid, and moxifloxacin (BPaL(M)) regimen for rifampicin-resistant tuberculosis in Europe: author's response', CLINICAL MICROBIOLOGY AND INFECTION , Jg. 30, Nr. 9, S. 1207-1208. https://doi.org/10.1016/j.cmi.2024.06.009
Lange, C, Mandalakas, AM, Lillebaek, T, Chesov, D, Dheda, K & Saluzzo, F 2024, 'Revisiting diagnostics: High priority tuberculosis diagnostic tests that fill an unmet need: what we need and what we don't', CLINICAL MICROBIOLOGY AND INFECTION . https://doi.org/10.1016/j.cmi.2024.12.020
Lienhardt, C, Dooley, KE, Nahid, P, Wells, C, Ryckman, TS, Kendall, EA, Davies, G, Brigden, G, Churchyard, G & Cirillo, DM et al. 2024, 'Target regimen profiles for tuberculosis treatment', Bulletin of the World Health Organization, Jg. 102, Nr. 8, S. 600-607. https://doi.org/10.2471/BLT.24.291881
Loebinger, MR, Aliberti, S, Haworth, C, Jankovic Makek, M, Lange, C, Lorent, N, Papavasileiou, A, Polverino, E, Rohde, G & Veziris, N et al. 2024, 'Patients at risk of nontuberculous mycobacterial pulmonary disease who need testing evaluated using a modified Delphi process by European experts', ERJ Open Research, Jg. 10, Nr. 5. https://doi.org/10.1183/23120541.00791-2023
Martinez, L, Seddon, JA, Horsburgh, CR, Lange, C, Mandalakas, AM & TB Contact Studies Consortium 2024, 'Effectiveness of preventive treatment among different age groups and Mycobacterium tuberculosis infection status: a systematic review and individual-participant data meta-analysis of contact tracing studies', Lancet Respiratory Medicine, Jg. 12, Nr. 8, S. 633-641. https://doi.org/10.1016/S2213-2600(24)00083-3
McClean, M, Panciu, TC, Lange, C, Duarte, R & Theis, F 2024, 'Artificial intelligence in tuberculosis: a new ally in disease control', Breathe, Jg. 20, Nr. 3, S. 240056. https://doi.org/10.1183/20734735.0056-2024
Meiwes, L, Kontsevaya, I, Chesov, D, Kulciţkaia, S, Dreyer, V, Hillemann, D, Dlamini, Q, Williams, C, Barer, M & Brinkmann, F et al. 2024, 'Whispers in the wind: Face mask sampling for Mycobacterium tuberculosis detection in children with pulmonary tuberculosis', JOURNAL OF INFECTIOUS DISEASES. https://doi.org/10.1093/infdis/jiae282
Ness, TE, Cirillo, DM & Mandalakas, AM 2024, 'Commentary: Mixed Infection or Heteroresistance? Pediatric Tuberculosis Still the Achilles Heel of Diagnostic Tools', The Pediatric infectious disease journal. https://doi.org/10.1097/INF.0000000000004648
Neuböck, MJ, and for CPAnet#, Günther, G, Barac, A, Davidsen, JR, Laursen, CB, Agarwal, R, Sehgal, IS, Lange, C & Salzer, HJF 2024, 'Chronic Pulmonary Aspergillosis as a Considerable Complication in Post-Tuberculosis Lung Disease', Seminars in respiratory and critical care medicine, Jg. 45, Nr. 1, S. 102-113. https://doi.org/10.1055/s-0043-1776913
Neumann, M, Reimann, M, Chesov, D, Popa, C, Dragomir, A, Popescu, O, Munteanu, R, Hölscher, A, Honeyborne, I, Heyckendorf, J, Lange, C, Hölscher, C & Kalsdorf, B 2024, 'The Molecular Bacterial Load Assay predicts treatment responses in patients with pre-XDR/XDR-tuberculosis more accurately than GeneXpert Ultra MTB/Rif', Journal of infection, S. 106399. https://doi.org/10.1016/j.jinf.2024.106399
Nieuwenhuizen, NE, Nouailles, G, Sutherland, JS, Zyla, J, Pasternack, AH, Heyckendorf, J, Frye, BC, Höhne, K, Zedler, U & Bandermann, S et al. 2024, 'Activin A levels are raised during human tuberculosis and blockade of the activin signaling axis influences murine responses to M. tuberculosis infection', mBio, Jg. 15, Nr. 3, S. e0340823. https://doi.org/10.1128/mbio.03408-23
Otto-Knapp, R, Bauer, T, Brinkmann, F, Feiterna-Sperling, C, Friesen, I, Geerdes-Fenge, H, Hartmann, P, Häcker, B, Heyckendorf, J & Kuhns, M et al. 2024, 'Treatment of MDR, Pre-XDR, XDR, and Rifampicin-Resistant Tuberculosis or in Case of Intolerance to at Least Rifampicin in Austria, Germany, and Switzerland', RESPIRATION, Jg. 103, Nr. 9, S. 593-600. https://doi.org/10.1159/000539410
Piric, M, Kosan, B, Manke, C, Khreish, F, Fink, L, Koehler, G, Lange, C, Gläser, S, Litzlbauer, D & Markart, P 2024, 'Eine seltene Ursache multipler kavernöser Veränderungen der Lunge', Pneumologie (Stuttgart, Germany). https://doi.org/10.1055/a-2486-6503
Rosenheim, J, Abebe, M, Belay, M, Tulu, B, Tayachew, D, Tegegn, M, Younis, S, Jolliffe, DA, Aseffa, A & Ameni, G et al. 2024, 'Detection of M. tuberculosis DNA in TB contacts' PBMC does not associate with blood RNA signatures for incipient tuberculosis', The European respiratory journal. https://doi.org/10.1183/13993003.00479-2024
Saktiawati, AMI, Vasiliu, A, Saluzzo, F & Akkerman, OW 2024, 'Strategies to Enhance Diagnostic Capabilities for the New Drug-Resistant Tuberculosis (DR-TB) Drugs', Pathogens, Jg. 13, Nr. 12. https://doi.org/10.3390/pathogens13121045
Salzer, HJF & Lange, C 2024, 'Aspergillus-specific IgG antibodies for diagnosing chronic pulmonary aspergillosis compared with the reference standard-author's reply: Aspergillus-specific IgG antibodies for diagnosing chronic pulmonary aspergillosis compared with the reference standard-author's reply', CLINICAL MICROBIOLOGY AND INFECTION , Jg. 30, Nr. 5, S. 696-697. https://doi.org/10.1016/j.cmi.2024.02.010
Schildkraut, JA, Köhler, N, Lange, C, Duarte, R & Gillespie, SH 2024, 'Advances in tuberculosis biomarkers: unravelling risk factors, active disease and treatment success', Breathe, Jg. 20, Nr. 3, S. 240003. https://doi.org/10.1183/20734735.0003-2024
Schönfeld, N, Barkane, L, Davoliene, I, Danilovits, M, Miliauskas, S, Ader, F, Kon, OM, Lange, C, Duvignaud, A & Heiss-Neumann, M et al. 2024, 'Real-life use of delamanid: results from the European post-authorisation safety study', IJTLD open, Jg. 1, Nr. 6, S. 274-278. https://doi.org/10.5588/ijtldopen.24.0113
Shaw, ES, Stoker, NG, Potter, JL, Claassen, H, Leslie, A, Tweed, CD, Chiang, C-Y, Conradie, F, Esmail, H & Lange, C et al. 2024, 'Bedaquiline: what might the future hold?', The Lancet. Microbe, S. 100909. https://doi.org/10.1016/S2666-5247(24)00149-6
Stoycheva, K, Cristea, V, Ködmön, C, Rosales-Klintz, S, Zenner, D, Vasiliu, A, van der Werf, M & Lange, C 2024, 'Tuberculosis in people of Ukrainian origin in the European Union and the European Economic Area, 2019 to 2022', Eurosurveillance, Jg. 29, Nr. 12, 2400094. https://doi.org/10.2807/1560-7917.ES.2024.29.12.2400094
Sutter, JP, Kocheise, L, Kempski, J, Christner, M, Wichmann, D, Pinnschmidt, H, Schmiedel, S, Lohse, AW, Huber, S & Brehm, TT 2024, 'Gentamicin combination treatment is associated with lower mortality in patients with invasive listeriosis: a retrospective analysis', Infection, Jg. 52, Nr. 4, S. 1601-1606. https://doi.org/10.1007/s15010-024-02330-w
Sutter, JP, Kocheise, L, Kempski, J, Christner, M, Wichmann, D, Pinnschmidt, H, Schmiedel, S, Lohse, AW, Huber, S & Brehm, TT 2024, 'Reply to: Challenges in interpreting the role of gentamicin in treatment of invasive listeriosis: immortal timebias and confounding', Infection. https://doi.org/10.1007/s15010-024-02417-4
Wetzstein, N, Dahl, VN, Lillebaek, T & Lange, C 2024, 'Clinical spectrum and relevance of Mycobacterium malmoense: Systematic review and meta-analysis of 859 patients', Journal of infection, Jg. 89, Nr. 2, S. 106203. https://doi.org/10.1016/j.jinf.2024.106203
Zielinski, N, Baiceanu, D, Dragomir, A, Heyckendorf, J, Ibraim, E, Köhler, N, Leschczyk, C, Popa, C, Rachow, A & Sachsenweger, J et al. 2024, 'A Transcriptomic Biomarker Predicting Linezolid-Associated Neuropathy During Treatment of Drug-Resistant Tuberculosis', Pathogens and Immunity, Jg. 9, Nr. 2, S. 25-42. https://doi.org/10.20411/pai.v9i2.705
2023
Brehm, TT, Köhler, N, Schmiedel, S, Terhalle, E, Martensen, J, Kalsdorf, B, Kandulla, J, Heyckendorf, J, Kuhns, M, Friesen, I & Lange, C 2023, 'Therapie der Tuberkulose: Was gibt es Neues?', Innere Medizin (Heidelberg, Germany), Jg. 64, Nr. 7, S. 701-707. https://doi.org/10.1007/s00108-023-01523-z
Butov, D, Feshchenko, Y, Chesov, D, Myasoedov, V, Kuzhko, M, Dudnyk, A, Reimann, M, Hryshchuk, L, Yareshko, A, Tkachenko, A, Tarleeva, Y, Konstantynovska, O, Butova, T & Lange, C 2023, 'National survey on the impact of the war in Ukraine on TB diagnostics and treatment services in 2022', INTERNATIONAL JOURNAL OF TUBERCULOSIS AND LUNG DISEASE, Jg. 27, Nr. 1, S. 86-88. https://doi.org/10.5588/ijtld.22.0563
Chesov, E, Chesov, D, Reimann, M, Dreyer, V, Utpatel, C, Gröschel, MI, Ciobanu, N, Crudu, V, Lange, C, Heyckendorf, J & Merker, M 2023, 'Impact of Mycobacterium tuberculosis strain type on multidrug-resistant tuberculosis severity, Republic of Moldova', Journal of infection, Jg. 87, Nr. 6, S. 588-591. https://doi.org/10.1016/j.jinf.2023.10.001
European Tuberculosis Network TBNET, Günther, G, Guglielmetti, L, Leu, C, Lange, C & van Leth, F 2023, 'Availability and costs of medicines for the treatment of tuberculosis in Europe', CLINICAL MICROBIOLOGY AND INFECTION , Jg. 29, Nr. 1, S. 77-84. https://doi.org/10.1016/j.cmi.2022.07.026
Günther, G, Guglielmetti, L, Leu, C, van Leth, F & Lange, C 2023, 'Relative cost of multidrug-resistant TB medicines in Europe', INTERNATIONAL JOURNAL OF TUBERCULOSIS AND LUNG DISEASE, Jg. 27, Nr. 5, S. 341-344. https://doi.org/10.5588/ijtld.23.0026
Hamada, Y, Gupta, RK, Quartagno, M, Izzard, A, Acuna-Villaorduna, C, Altet, N, Diel, R, Dominguez, J, Floyd, S, Gupta, A, Huerga, H, Jones-López, EC, Kinikar, A, Lange, C, van Leth, F, Liu, Q, Lu, W, Lu, P, Rueda, IL, Martinez, L, Mbandi, SK, Muñoz, L, Padilla, ES, Paradkar, M, Scriba, T, Sester, M, Shanaube, K, Sharma, SK, Sloot, R, Sotgiu, G, Thiruvengadam, K, Vashishtha, R, Abubakar, I & Rangaka, MX 2023, 'Predictive performance of interferon-gamma release assays and the tuberculin skin test for incident tuberculosis: an individual participant data meta-analysis', EClinicalMedicine, Jg. 56, S. 101815. https://doi.org/10.1016/j.eclinm.2022.101815
Hamada, Y, Kontsevaya, I, Surkova, E, Wang, TT, Wan-Hsin, L, Matveev, A, Ziganshina, LE, Denkinger, CM, Korobitsyn, A, Ismail, N, Abubakar, I & Rangaka, MX 2023, 'A Systematic Review on the Safety of Mycobacterium tuberculosis-Specific Antigen-Based Skin Tests for Tuberculosis Infection Compared With Tuberculin Skin Tests', Open forum infectious diseases, Jg. 10, Nr. 5, S. ofad228. https://doi.org/10.1093/ofid/ofad228
Ivanova, O, Hoffmann, VS, Lange, C, Hoelscher, M & Rachow, A 2023, 'Post-tuberculosis lung impairment: systematic review and meta-analysis of spirometry data from 14 621 people', European Respiratory Review, Jg. 32, Nr. 168, S. 220221. https://doi.org/10.1183/16000617.0221-2022
Koehler, N, Andres, S, Merker, M, Dreyer, V, John, A, Kuhns, M, Krieger, D, Choong, E, Verougstraete, N, Zur Wiesch, PA, Wicha, SG, König, C, Kalsdorf, B, Sanchez Carballo, PM, Schaub, D, Werngren, J, Schön, T, Peloquin, CA, Schönfeld, N, Verstraete, AG, Decosterd, LA, Aarnoutse, R, Niemann, S, Maurer, FP & Lange, C 2023, 'Pretomanid-Resistant Tuberculosis', Journal of infection, Jg. 86, Nr. 5, S. 520-524. https://doi.org/10.1016/j.jinf.2023.01.039
Kontsevaya, I, Cabibbe, AM, Cirillo, DM, DiNardo, AR, Frahm, N, Gillespie, SH, Holtzman, D, Meiwes, L, Petruccioli, E, Reimann, M, Ruhwald, M, Sabiiti, W, Saluzzo, F, Tagliani, E & Goletti, D 2023, 'Update on the diagnosis of tuberculosis', CLINICAL MICROBIOLOGY AND INFECTION . https://doi.org/10.1016/j.cmi.2023.07.014
Lange, C 2023, 'Management der antibiotikaresistenten Tuberkulose', Deutsche medizinische Wochenschrift (1946), Jg. 148, Nr. 19, S. 1236-1241. https://doi.org/10.1055/a-1939-0000
Lange, C 2023, 'Mission (im)possible: elimination of tuberculosis', CLINICAL MICROBIOLOGY AND INFECTION . https://doi.org/10.1016/j.cmi.2023.07.033
Lange, C, Brehm, TT, Chesov, D, Kherabi, Y & Guglielmetti, L 2023, Treatment of drug-susceptible and drug-resistant tuberculosis. European Respiratory Society. https://doi.org/10.1183/2312508X.10024622
Lange, C, Köhler, N & Günther, G 2023, 'Regimens for Drug-Resistant Tuberculosis', New England Journal of Medicine, Jg. 388, Nr. 2, S. 189-191. https://doi.org/10.1056/NEJMc2213970
Lange, C, Vasiliu, A & Mandalakas, AM 2023, 'Emerging bedaquiline-resistant tuberculosis', The Lancet. Microbe, Jg. 4, Nr. 12, S. e964-e965. https://doi.org/10.1016/S2666-5247(23)00321-X
Maier, C, Chesov, D, Schaub, D, Kalsdorf, B, Andres, S, Friesen, I, Reimann, M & Lange, C 2023, 'Long-term treatment outcomes in patients with multidrug-resistant tuberculosis', CLINICAL MICROBIOLOGY AND INFECTION , Jg. 29, Nr. 6, S. 751-757. https://doi.org/10.1016/j.cmi.2023.02.013
Motta, I, Boeree, M, Chesov, D, Dheda, K, Günther, G, Horsburgh, CR, Kherabi, Y, Lange, C, Lienhardt, C, McIlleron, HM, Paton, NI, Stagg, HR, Thwaites, G, Udwadia, Z, Van Crevel, R, Velásquez, GE, Wilkinson, RJ & Guglielmetti, L 2023, 'Recent advances in the treatment of tuberculosis', CLINICAL MICROBIOLOGY AND INFECTION . https://doi.org/10.1016/j.cmi.2023.07.013
Ness, T, Van, LH, Petermane, I, Duarte, R, Lange, C, Menzies, D & Cirillo, DM 2023, 'Rolling out new anti-tuberculosis drugs without diagnostic capacity', Breathe, Jg. 19, Nr. 2, S. 230084. https://doi.org/10.1183/20734735.0084-2023
Ness, TE, Meiwes, L, Kay, A, Mejia, R, Lange, C, Farhat, M, Mandalakas, A & DiNardo, A 2023, 'Optimizing DNA Extraction from Pediatric Stool for Diagnosis of Tuberculosis and Use in Next-Generation Sequencing Applications', Microbiology spectrum, Jg. 11, Nr. 1, S. e0226922. https://doi.org/10.1128/spectrum.02269-22
Noroc, E, Chesov, D, Merker, M, Gröschel, MI, Barilar, I, Dreyer, V, Ciobanu, N, Reimann, M, Crudu, V & Lange, C 2023, 'Limited Nosocomial Transmission of Drug-Resistant Tuberculosis, Moldova', EMERGING INFECTIOUS DISEASES, Jg. 29, Nr. 5, S. 1046-1050. https://doi.org/10.3201/eid2905.230035
Pedersen, OS, Holmgaard, FB, Mikkelsen, MKD, Lange, C, Sotgiu, G, Lillebaek, T, Andersen, AB, Wejse, CM & Dahl, VN 2023, 'Global treatment outcomes of extensively drug-resistant tuberculosis in adults: A systematic review and meta-analysis', Journal of infection, Jg. 87, Nr. 3, S. 177-189. https://doi.org/10.1016/j.jinf.2023.06.014
Sandoval, M, Mtetwa, G, Devezin, T, Vambe, D, Sibanda, J, Dube, GS, Dlamini-Simelane, T, Lukhele, B, Mandalakas, AM & Kay, A 2023, 'Community-based tuberculosis contact management: Caregiver experience and factors promoting adherence to preventive therapy', PLOS global public health, Jg. 3, Nr. 7, S. e0001920. https://doi.org/10.1371/journal.pgph.0001920
TBNET and RESIST-TB networks, Domínguez, J, Boeree, MJ, Cambau, E, Chesov, D, Conradie, F, Cox, V, Dheda, K, Dudnyk, A, Farhat, MR, Gagneux, S, Grobusch, MP, Gröschel, MI, Guglielmetti, L, Kontsevaya, I, Lange, B, van Leth, F, Lienhardt, C, Mandalakas, AM, Maurer, FP, Merker, M, Miotto, P, Molina-Moya, B, Morel, F, Niemann, S, Veziris, N, Whitelaw, A, Horsburgh, CR & Lange, C 2023, 'Clinical implications of molecular drug resistance testing for Mycobacterium tuberculosis: a 2023 TBnet/RESIST-TB consensus statement', Lancet Infectious Diseases, Jg. 23, Nr. 4, S. e122-e137. https://doi.org/10.1016/S1473-3099(22)00875-1
UNITE4TB Consortium 2023, 'Implementing molecular tuberculosis diagnostic methods in limited-resource and high-burden countries', Breathe, Jg. 18, Nr. 4, S. 220226. https://doi.org/10.1183/20734735.0226-2022
UNITE4TB Consortium 2023, 'Tuberculosis: current challenges and beyond', Breathe, Jg. 19, Nr. 1, S. 220166. https://doi.org/10.1183/20734735.0166-2022
2022
Akkerman, OW, Duarte, R, Tiberi, S, Schaaf, HS, Lange, C, Alffenaar, JWC, Denholm, J, Carvalho, ACC, Bolhuis, MS, Borisov, S, Bruchfeld, J, Cabibbe, AM, Caminero, JA, Carvalho, I, Chakaya, J, Centis, R, Dalcomo, MP, D Ambrosio, L, Dedicoat, M, Dheda, K, Dooley, KE, Furin, J, García-García, J-M, van Hest, NAH, de Jong, BC, Kurhasani, X, Märtson, AG, Mpagama, S, Torrico, MM, Nunes, E, Ong, CWM, Palmero, DJ, Ruslami, R, Saktiawati, AMI, Semuto, C, Silva, DR, Singla, R, Solovic, I, Srivastava, S, de Steenwinkel, JEM, Story, A, Sturkenboom, MGG, Tadolini, M, Udwadia, ZF, Verhage, AR, Zellweger, JP & Migliori, GB 2022, 'Clinical standards for drug-susceptible pulmonary TB', INTERNATIONAL JOURNAL OF TUBERCULOSIS AND LUNG DISEASE, Jg. 26, Nr. 7, S. 592-604. https://doi.org/10.5588/ijtld.22.0228
Brandenburg, J, Heyckendorf, J, Marwitz, F, Zehethofer, N, Linnemann, L, Gisch, N, Karaköse, H, Reimann, M, Kranzer, K, Kalsdorf, B, Sanchez-Carballo, P, Weinkauf, M, Scholz, V, Malm, S, Homolka, S, Gaede, KI, Herzmann, C, Schaible, UE, Hölscher, C, Reiling, N & Schwudke, D 2022, 'Tuberculostearic Acid-Containing Phosphatidylinositols as Markers of Bacterial Burden in Tuberculosis', ACS infectious diseases, Jg. 8, Nr. 7, S. 1303-1315. https://doi.org/10.1021/acsinfecdis.2c00075
Chesov, E, Chesov, D, Maurer, FP, Andres, S, Utpatel, C, Barilar, I, Donica, A, Reimann, M, Niemann, S, Lange, C, Crudu, V, Heyckendorf, J & Merker, M 2022, 'Emergence of bedaquiline resistance in a high tuberculosis burden country', The European respiratory journal, Jg. 59, Nr. 3, 2100621. https://doi.org/10.1183/13993003.00621-2021
COVICAT study group, Aachen Study (COVAS) 2022, 'Detailed stratified GWAS analysis for severe COVID-19 in four European populations', HUMAN MOLECULAR GENETICS , Jg. 31, Nr. 23, S. 3945-3966. https://doi.org/10.1093/hmg/ddac158
Donald, P, Kaufmann, S, Thee, S, Mandalakas, AM & Lange, C 2022, 'Pathogenesis of tuberculosis: the 1930 Lübeck disaster revisited', European Respiratory Review, Jg. 31, Nr. 164, 220046. https://doi.org/10.1183/16000617.0046-2022
DZIF-TB cohort study group 2022, 'Gene expression signatures identify biologically and clinically distinct tuberculosis endotypes', The European respiratory journal, Jg. 60, Nr. 3. https://doi.org/10.1183/13993003.02263-2021
European Conference on Infections in Leukaemia group 2022, 'Mycobacterial infections in adults with haematological malignancies and haematopoietic stem cell transplants: guidelines from the 8th European Conference on Infections in Leukaemia', Lancet Infectious Diseases, Jg. 22, Nr. 12, S. e359-e369. https://doi.org/10.1016/S1473-3099(22)00227-4
expert panel group for management recommendations in non-tuberculous mycobacterial pulmonary diseases 2022, 'Consensus management recommendations for less common non-tuberculous mycobacterial pulmonary diseases', Lancet Infectious Diseases, Jg. 22, Nr. 7, S. e178-e190. https://doi.org/10.1016/S1473-3099(21)00586-7
Günther, G, Saathoff, E, Rachow, A, Ekandjo, H, Diergaardt, A, Marais, N, Lange, C & Nepolo, E 2022, 'Clinical Evaluation of a Line-Probe Assay for Tuberculosis Detection and Drug-Resistance Prediction in Namibia', Microbiology spectrum, Jg. 10, Nr. 3, S. e0025922. https://doi.org/10.1128/spectrum.00259-22
Gutowski, J-P, Sachsenweger, J, May, K, Lange, C & Heyckendorf, J 2022, 'Eine unerwartete Komplikation: Kontralateraler Spannungspneumothorax nach transbronchialer Zangenbiopsie', Pneumologie (Stuttgart, Germany), Jg. 76, Nr. 9, S. 622-625. https://doi.org/10.1055/a-1775-5693
Lange, C, Aaby, P, Behr, MA, Donald, PR, Kaufmann, SHE, Netea, MG & Mandalakas, AM 2022, '100 years of Mycobacterium bovis bacille Calmette-Guérin', Lancet Infectious Diseases, Jg. 22, Nr. 1, S. e2-e12. https://doi.org/10.1016/S1473-3099(21)00403-5
Lange, C, Kay, A & Mandalakas, AM 2022, 'The need for effective drugs for TB prevention: set your goals high, and don´t stop till you get there', INTERNATIONAL JOURNAL OF TUBERCULOSIS AND LUNG DISEASE, Jg. 26, Nr. 2, S. 85-88. https://doi.org/10.5588/ijtld.21.0736
Martinez, L, Cords, O, Liu, Q, Acuna-Villaorduna, C, Bonnet, M, Fox, GJ, Carvalho, ACC, Chan, P-C, Croda, J, Hill, PC, Lopez-Varela, E, Donkor, S, Fielding, K, Graham, SM, Espinal, MA, Kampmann, B, Reingold, A, Huerga, H, Villalba, JA, Grandjean, L, Sotgiu, G, Egere, U, Singh, S, Zhu, L, Lienhardt, C, Denholm, JT, Seddon, JA, Whalen, CC, García-Basteiro, AL, Triasih, R, Chen, C, Singh, J, Huang, L-M, Sharma, S, Hannoun, D, Del Corral, H, Mandalakas, AM, Malone, LL, Ling, D-L, Kritski, A, Stein, CM, Vashishtha, R, Boulahbal, F, Fang, C-T, Boom, WH, Netto, EM, Lemos, AC, Hesseling, AC, Kay, A, Jones-López, EC, Horsburgh, CR, Lange, C & Andrews, JR 2022, 'Infant BCG vaccination and risk of pulmonary and extrapulmonary tuberculosis throughout the life course: a systematic review and individual participant data meta-analysis', The Lancet. Global health, Jg. 10, Nr. 9, S. e1307-e1316. https://doi.org/10.1016/S2214-109X(22)00283-2
Mercier, T, Desfontaine, V, Cruchon, S, Da Silva Pereira Clara, JA, Briki, M, Mazza-Stalder, J, Kajkus, A, Burger, R, Suttels, V, Buclin, T, Opota, O, Koehler, N, Sanchez Carballo, PM, Lange, C, André, P, Decosterd, LA & Choong, E 2022, 'A battery of tandem mass spectrometry assays with stable isotope-dilution for the quantification of 15 anti-tuberculosis drugs and two metabolites in patients with susceptible-, multidrug-resistant- and extensively drug-resistant tuberculosis', JOURNAL OF CHROMATOGRAPHY B-ANALYTICAL TECHNOLOGIES IN THE BIOMEDICAL AND LIFE SCIENCES, Jg. 1211, S. 123456. https://doi.org/10.1016/j.jchromb.2022.123456
Rachow, A, Saathoff, E, Mindru, R, Popescu, O, Lugoji, D, Mahler, B, Merker, M, Niemann, S, Olaru, ID, Kastner, S, Hoelscher, M, Lange, C & Ibraim, E 2022, 'Diagnostic performance of the AID line probe assay in the detection of Mycobacterium tuberculosis and drug resistance in Romanian patients with presumed TB', PLOS ONE, Jg. 17, Nr. 8, S. e0271297. https://doi.org/10.1371/journal.pone.0271297
Ramachandran, R, Dumitrescu, A, Baiceanu, D, Popa, C, Dragomir, A, Mahler, B, Hoelscher, M, Lange, C, Heyckendorf, J, Rachow, A, Ibraim, E & Ivanova, O 2024, 'Impact of drug-resistant tuberculosis on socio-economic status, quality of life and psychological well-being of patients in Bucharest, Romania: a prospective cohort study', Journal of health, population, and nutrition, Jg. 43, Nr. 1, S. 223. https://doi.org/10.1186/s41043-024-00717-x
Rauch, A, Köhler, N, Brehm, TT, Zielinski, N, Stoycheva, K, Maier, C, Böttcher, L, Friesen, I, Schaub, D, Reimann, M, Schmiedel, S, Lange, C & Kalsdorf, B 2024, 'Long-Term Self-Administered Outpatient Parenteral Antimicrobial Therapy in the Treatment of Tuberculosis', Drugs. https://doi.org/10.1007/s40265-024-02122-4
Schaberg, T, Brinkmann, F, Feiterna-Sperling, C, Geerdes-Fenge, H, Hartmann, P, Häcker, B, Hauer, B, Haas, W, Heyckendorf, J, Lange, C, Maurer, FP, Nienhaus, A, Otto-Knapp, R, Priwitzer, M, Richter, E, Salzer, HJF, Schoch, O, Schönfeld, N, Stahlmann, R & Bauer, T 2022, 'Tuberkulose im Erwachsenenalter', Pneumologie (Stuttgart, Germany), Jg. 76, Nr. 11, S. 727-819. https://doi.org/10.1055/a-1934-8303
Sibandze, DB, Kay, A, Dreyer, V, Sikhondze, W, Dlamini, Q, DiNardo, A, Mtetwa, G, Lukhele, B, Vambe, D, Lange, C, Glenn Dlamini, M, Ness, T, Mejia, R, Kalsdorf, B, Heyckendorf, J, Kuhns, M, Maurer, FP, Dlamini, S, Maphalala, G, Niemann, S & Mandalakas, A 2022, 'Rapid molecular diagnostics of tuberculosis resistance by targeted stool sequencing', Genome medicine, Jg. 14, Nr. 1, S. 52. https://doi.org/10.1186/s13073-022-01054-6
Study Group on Mycobacteria of the European Society of Microbiology and Infectious Diseases (ESGMYC), European Society of Mycobacteriology (ESM), European Respiratory Society (ERS) and 2022, 'Rifapentine access in Europe: growing concerns over key tuberculosis treatment component', The European respiratory journal, Jg. 59, Nr. 5, S. 2200388. https://doi.org/10.1183/13993003.00388-2022
TBnet, The ESGMYC, and The French MDR-TB Group 2022, 'Co-administration of treatment for rifampicin-resistant TB and chronic HCV infection: a TBnet and ESGMYC study', Journal of infection, Jg. 84, Nr. 6, S. 834-872. https://doi.org/10.1016/j.jinf.2022.03.004
Tran, F, Harris, DMM, Scharmacher, A, Graßhoff, H, Sterner, K, Schinke, S, Käding, N, Humrich, JY, Cabral-Marques, O, Bernardes, JP, Mishra, N, Bahmer, T, Franzenburg, J, Hoyer, BF, Glück, A, Guggeis, M, Ossysek, A, Küller, A, Frank, D, Lange, C, Rupp, J, Heyckendorf, J, Gaede, KI, Amital, H, Rosenstiel, P, Shoenfeld, Y, Halpert, G, Rosenberg, AZ, Schulze-Forster, K, Heidecke, H, Riemekasten, G & Schreiber, S 2022, 'Increased protease-activated receptor 1 autoantibodies are associated with severe COVID-19', ERJ Open Research, Jg. 8, Nr. 4. https://doi.org/10.1183/23120541.00379-2022
UNITE4TB Consortium 2022, 'Tuberculosis Treatment Monitoring and Outcome Measures: New Interest and New Strategies', Clinical microbiology reviews, Jg. 35, Nr. 3, S. e0022721. https://doi.org/10.1128/cmr.00227-21
Leitung der Forschungsgruppe

Wissenschaftliche Mitarbeiter:innen



















Projektassistenz

Technische Mitarbeiter:innen




Datenmanagement